Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > J Clin Nutr > Volume 10(1); 2018 > Article
- Original Article Effects of Parenteral Nutrition in Pediatric Patients with Hematopoietic Stem Cell Transplantation
- Soo Young Lim1, Min Jae Jung1,2, Ji Eun Park1,2, Jae Song Kim1, Soo Hyun Kim1, Chuhl Joo Lyu3, Eun Sun Son1
- 조혈모세포이식을 시행한 소아 환자에서 정맥영양의 유효성 평가
- 임수영1, 정민재1,2, 박지은1,2, 김재송1, 김수현1, 유철주3, 손은선1
-
Journal of the Korean Society for Parenteral and Enteral Nutrition 2018;10(1):9-19.
DOI: https://doi.org/10.15747/jcn.2018.10.1.9
Published online: June 30, 2018
Department of Pharmacy
Pediatric Nutrition Support Team
Department of Pediatric Hematology Oncology, Severance Hospital, Yonsei University Health System, Seoul, Korea
- Correspondence to Eun Sun Son Department of Pharmacy, Severance Hospital, Yonsei University Health System, 50-1 Yonsei-ro, Seodaemun-gu, Seoul 03722, Korea Tel: +82-2-2228-6896, Fax: +82-2-2227-7983, E-mail: SESPHARM@yuhs.ac
Copyright: © Korean Society for Parenteral and Enteral Nutrition
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 614 Views
- 4 Download
Abstract
-
Purpose: This study examined the effects of parenteral nutrition (PN) on the nutritional status, clinical improvement, and PN-related complications in pediatric patients who had undergone hematopoietic stem cell transplantation (HSCT).
-
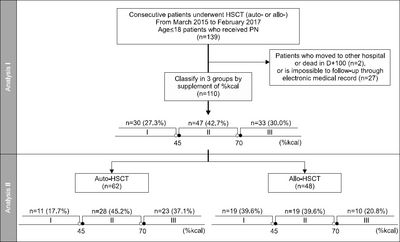
Methods: A retrospective audit of 110 pediatric patients (age≤18), who underwent HSCT from March 2015 to February 2017 was undertaken. The patients were divided into 3 groups based on the ratio of daily calorie supplementation to the daily calorie requirement (ROCS). The clinical factors related to the nutritional status, such as difference in body weight (BW), body mass index (BMI), percent ideal body weight (PIBW), total protein (T.protein), and albumin; the early clinical outcome, such as PN-duration, length of hospitaliaztion (LOH), engraftment day (ED), graft-versus-host disease, sepsis, pneumonia and mucositis; and PN-related complications, including elevation of total bilirubin (T.bil), direct bilirubin (D.bil), aspartate aminotransferase, alanine aminotransferase, glucose and cholesterol levels, and hepatic veno-occlusive disease were analyzed using the electronic medical records. Additional analysis subject to auto-HSCT and allo-HSCT patients was also performed.
-
Results: The very-low-ROCS, low-ROCS, and satisfied-ROCS group were 30 (27.3%), 47 (42.7%), and 33 (30.0%) patients, respectively. The PN-duration (P=0.005, z=–2.271), LOH (P=0.023, z=–2.840), ED (P<0.001, z=–3.695), T.bil elevation (P<0.001, z=–3.660), and D.bil elevation (P=0.002, z=–3.064) tended to decrease with increasing ROCS. The difference in the PN-duration (P=0.017), ED (P=0.001), T.bil elevation (P=0.001), and D.bil elevation (P=0.011) in the 3 groups was statistically significant. In the auto-HSCT patients, the change in BW (P=0.031, z=+2.154), PIBW (P=0.029, z=+2.187), and BMI (P=0.021, z=+2.306) tended to increase. In the allo-HSCT patients, the change in T.protein (P=0.022, z=+2.286) increased but the ED (P=0.021, z=–2.304) decreased.
-
Conclusion: Aggressive PN supplementation has an effect on maintaining the nutritional status and achieving better early outcomes in pediatric HSCT patients, whereas it has no effect on increasing the PN-related complications.
서론
대상 및 방법
1) 수집기간
2) 선정 및 제외기준
결과
| Characteristic | Group I (n=30) | Group II (n=47) | Group III (n=33) | P-value |
|---|---|---|---|---|
| Patients | 30 (27.3) | 47 (42.7) | 33 (30.0) | |
| Sex | 0.650 | |||
| Male | 21 (70.0) | 28 (59.6) | 21 (63.6) | |
| Female | 9 (30.0) | 19 (40.4) | 12 (36.4) | |
| Age (y) | 13 (1.0∼17.0) | 4.5 (0.0∼18.0) | 3.5 (0.0∼17.0) | 0.002a |
| Group of age (y) | <0.001a | |||
| Neonate & infant (0≤y<2) | 2 (6.7) | 4 (8.5) | 9 (27.3) | |
| Early childhood (2≤y<6) | 8 (26.7) | 22 (46.8) | 12 (36.4) | |
| Middle childhood (6≤y<12) | 2 (6.7) | 12 (25.5) | 7 (21.2) | |
| Early adolescence (12≤y<19) | 18 (60.0) | 9 (19.1) | 5 (15.2) | |
| Body weight (kg) | 44.0 (10.5∼67.6) | 18.1 (9.5∼72.5) | 15.6 (7.5∼-57.5) | <0.001a |
| %IBW (%)b | 97.8 (67.4∼171.8) | 101.1 (71.6∼135.8) | 98.1 (27.5∼146.8) | 0.710 |
| BMI (kg/m2)c | 18.9 (15.1∼28.1) | 16.5 (13.0∼24.2) | 16.2 (13.6∼22.7) | 0.013a |
| Type of parenteral nutrition | 0.406 | |||
| 2-in-1 (glucose based) | 2 (6.7) | 2 (4.3) | 4 (12.1) | |
| 3-in-1 (lipid based) | 28 (93.3) | 45 (95.7) | 29 (87.9) | |
| ROCS | 37.0 (3.0∼44.0) | 54.0 (45.0∼69.0) | 87.0 (71.0∼121.0) | <0.001a |
| Primary disease | 0.035a | |||
| ALL | 9 (30.0) | 12 (25.5) | 2 (6.1) | |
| AML | 7 (23.3) | 7 (14.9) | 2 (6.1) | |
| CML | 1 (3.3) | 0 (0.0) | 0 (0.0) | |
| Malignant lymphoma | 2 (6.7) | 1 (2.1) | 1 (3.0) | |
| Ewing’s sarcoma | 1 (3.3) | 0 (0.0) | 1 (3.0) | |
| Wilms’ tumor | 0 (0.0) | 1 (2.1) | 3 (9.1) | |
| Brain tumor | 3 (10.0) | 11 (23.4) | 14 (42.4) | |
| Neuroblastoma | 2 (6.7) | 8 (17.0) | 3 (9.1) | |
| Aplastic anemia | 3 (10.0) | 1 (2.1) | 5 (15.2) | |
| Rhabdomyosarcoma | 2 (6.7) | 5 (10.6) | 1 (3.0) | |
| Etc. | 0 (0.0) | 1 (2.1) | 1 (3.0) | |
| Graft type | 0.026a | |||
| Autologous HSCT | 11 (36.7) | 28 (59.6) | 23 (69.7) | |
| Allogeneic HSCT | 19 (63.3) | 19 (40.4) | 10 (30.3) | |
| Stem cell source | 0.043a | |||
| Peripheral blood | 22 (73.3) | 42 (89.4) | 31 (93.9) | |
| Bone marrow | 8 (26.7) | 5 (10.6) | 2 (6.1) |
Values are presented as number (%) or median (range).
HSCT = hematopoietic stem cell transplantation; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; %IBW = %ideal body weight; BMI = body mass index; ROCS = ratio of daily calorie supplementation to the daily calorie requirement; ALL = acute lymphocytic leukemia; AML = acute malignant leukemia; CML = chronic malignant leukemia.
aP<0.05.
b%IBW (%)=(body weight)/(IBW)×100.
cBMI (kg/m2)=(body weight)/(height)2.
| Serum concentration | Group I (n=30) | Group II (n=47) | Group III (n=33) | P-value |
|---|---|---|---|---|
| Total protein (g/dL) | 5.9 (4.8~8.5) | 5.8 (4.3~6.8) | 5.8 (1.2~6.7) | 0.693 |
| Albumin (g/dL) | 3.8 (3.2~4.9) | 3.8 (2.8~4.4) | 3.8 (2.9~4.3) | 0.839 |
| Total bilirubin (mg/dL) | 0.6 (0.1~4.8) | 0.3 (0.1~1.6) | 0.3 (0.1~1.4) | 0.012a |
| Direct bilirubin (mg/dL) | 0.2 (0.1~1.1) | 0.1 (0.1~0.7) | 0.1 (0.1~0.6) | 0.043a |
| AST (IU/L) | 38.5 (10.0~711) | 47.0 (12.0~265) | 48.5 (16.0~421) | 0.832 |
| ALT (IU/L) | 35.0 (14.0~884) | 54.5 (9.0~213) | 39.0 (9.0~210) | 0.705 |
| Glucose (mg/dL) | 105 (75.0~360) | 99.0 (71.0~318) | 98.0 (79.0~155) | 0.281 |
| Cholesterol (mg/dL) | 149.5 (72.0~235) | 147.5 (96.0~300) | 138.5 (89.0~207) | 0.138 |
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value |
|---|---|---|---|---|---|---|
| Percentile of ΔBWa (%) | –3.9 (–16.3~+7.6)/47.8 | –1.5 (–23.6~+8.2)/55.5 | –0.4 (–40~+4.6)/62.5 | 0.186 | 0.056 | +1.907 |
| Δ%Ideal body weightb (%) | –4.0 (–17.2~+9.6)/48.6 | –1.4 (–23.8~+7.8)/55.7 | –0.8 (–39.3~+4.9)/61.6 | 0.270 | 0.090 | +1.696 |
| ΔBody mass indexb (kg/m2) | –7.6 (–3.2~+2.0)/47.9 | –0.3 (–5.0~+1.5)/56.2 | –0.2 (–6.2~+0.8)/61.5 | 0.230 | 0.078 | +1.763 |
| ΔTotal proteinb (g/dL) | 0.3 (–1.2~+1.9)/50.5 | 0.4 (–1.8~+2.1)/57.2 | 0.8 (–2.1~+4.8)/57.6 | 0.603 | 0.361 | +0.914 |
| ΔAlbuminb (g/dL) | –0.2 (–0.9~+0.8)/48.7 | –0.1 (–1.4~+1.0)/58.0 | –0.1 (–1.9~+0.9)/58.1 | 0.391 | 0.243 | +1.168 |
Values are presented as median (range)/mean rank.
D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal~<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; BW = body weight.
aPercentile of ΔBW (%)=[{(BW of last–PN day)–(BW of D-1)}/(BW of D-1)]×100.
bΔdata=(data of last–PN day)–(data of D-1).
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value | P-value | I vs. II P-value | I vs. III P-value | II vs. III P-value |
|---|---|---|---|---|---|---|---|---|---|---|
| Duration of PN administration (d) | 21.5 (8.0∼98.0)/67.1 | 18.5 (9.0∼155.0)/56.1 | 17.0 (1.0∼41.0)/44.2 | 0.017a | 0.005a | –2.271 | ||||
| Length of hospital stay (d) | 32.0 (23.0∼194.0)/66.3 | 30.5 (17.0∼175.0)/54.1 | 30.0 (15.0∼82.0)/47.7 | 0.063 | 0.023a | –2.840 | ||||
| Engraft day (d) | 15.5 (9.0 ~+22.0)/72.0 | 12.0 (10.0 ~+93.0)/54.0 | 12.0 (9.0 ~+19.0)/42.7 | 0.001a | <0.001a | –3.695 | ||||
| GVHD | 6 (20.0) | 9 (19.1) | 3 (9.1) | 0.400 | ||||||
| Sepsis | 4 (13.3) | 7 (14.9) | 3 (9.1) | 0.740 | ||||||
| Pneumonia | 8 (26.7) | 14 (29.8) | 5 (15.2) | 0.310 | ||||||
| Mucositis | 15 (50.0) | 22 (46.8) | 13 (39.4) | 0.679 | ||||||
| Analysis of statistically significant differences between 2-groups by Mann-Whitney test, mean rank | ||||||||||
| Duration of PN administration (d) | 43.6 | 36.1 | 0.149 | |||||||
| 39.0 | 25.6 | 0.004b | ||||||||
| 44.0 | 35.5 | 0.108 | ||||||||
| Engraft day (d) | 46.9 | 33.9 | 0.012b | |||||||
| 40.6 | 24.2 | <0.001b | ||||||||
| 44.1 | 35.4 | 0.098 | ||||||||
Values are presented as median (range)/mean rank, number (%), or mean rank only.
D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; GVHD = graft-versus-host disease.
aP<0.05.
bStatistically significant when P<0.017 in Mann-Whitney test.
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value | P-value | I vs. II P-value | I vs. III P-value | II vs. III P-value |
|---|---|---|---|---|---|---|---|---|---|---|
| ΔTotal bilibulin (mg/dL)b | 0.8 (0.0∼32.4)/71.1 | 0.4 (0.0∼54.5)/54.9 | 0.2 (0.0∼5.3)/42.2 | 0.001a | <0.001a | –3.660 | ||||
| ΔDirect bilibulin (mg/dL)b | 0.3 (0.0∼26.2)/64.1 | 0.1 (0.6∼+42.1)/51.9 | 0.0 (–0.4∼+4.4)/40.8 | 0.011a | 0.002a | –3.064 | ||||
| ΔAST (IU/L)b | 30.5 (–3.0∼+2353.0)/61.3 | 20.5 (0.0∼+1294.0)/55.4 | 19.0 (0.0∼+2134.0)/50.3 | 0.388 | 0.177 | –1.349 | ||||
| ΔALT (IU/L)b | 31.0 (0.0∼+1400.0)/60.7 | 16.0 (–11.0∼+1274.0)/55.9 | 12.0 (0.0∼+1001.0)/50.2 | 0.419 | 0.197 | –1.291 | ||||
| ΔGlucose (mg/dL)b | 42.5 (0.0∼248.0)/49.5 | 69.5 (0.0∼474.0)/63.2 | 43 (0.0∼801.0)/50.0 | 0.089 | 0.999 | <0.001 | ||||
| ΔCholesterol (mg/dL)b | 25.5 (–4.0∼+157.0)/52.6 | 33.0 (0.0∼212.0)/56.7 | 34.5 (0.0∼87.0)/56.4 | 0.837 | 0.658 | +0.443 | ||||
| VOD development | 8 (26.7) | 10 (21.3) | 3 (9.1) | 0.183 | ||||||
| Analysis of statistically significant differences between 2-groups by Mann-Whitney test, mean rank | ||||||||||
| ΔTotal bilibulin (mg/dL)b | 46.3 | 34.4 | 0.022 | |||||||
| 40.3 | 24.4 | 0.001c | ||||||||
| 44.6 | 34.7 | 0.060 | ||||||||
| ΔDirect bililubin (mg/dL)b | 40.4 | 32.2 | 0.094 | |||||||
| 37.2 | 24.6 | 0.004c | ||||||||
| 41.2 | 32.6 | 0.078 | ||||||||
Values are presented as median (range)/mean rank, number(%), or mean rank only.
PN = parenteral nutrition; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; AST = aspartate aminotransferase; ALT = alanine aminotransferase; VOD = hepatic veno-occlusive disease.
aP<0.05.
bΔdata=(maximum data from D-1 to last–PN day)–(data of D-1).
cStatistically significant when P<0.017 in Mann-Whitney test.
고찰
결론
- 1. Hwang TJ. Hematopoietic stem cell transplantation:overview for general pediatrician. Korean J Pediatr 2007;50(7):613-21. Article
- 2. Corkins MR, Balint J, Bobo E, Plogsted S, Yaworski JA. The A.S.P.E.N. pediatric nutrition support core curriculum. 2nd ed. Silver Spring: American Society for Parenteral and Enteral Nutrition; 2015. p. 694.
- 3. Williams NS, Evans P, King RF. Gastric acid secretion and gastrin production in the short bowel syndrome. Gut 1985;26(9):914-9. ArticlePubMedPMC
- 4. Duggan C, Bechard L, Donovan K, Vangel M, O'Leary A, Holmes C, et al. Changes in resting energy expenditure among children undergoing allogeneic stem cell transplantation. Am J Clin Nutr 2003;78(1):104-9. ArticlePubMed
- 5. Duro D, Bechard LJ, Feldman HA, Klykov A, O'Leary A, Guinan EC, et al. Weekly measurements accurately represent trends in resting energy expenditure in children undergoing hematopoietic stem cell transplantation. JPEN J Parenter Enteral Nutr 2008;32(4):427-32. ArticlePubMedPMCPDF
- 6. Merritt RJ, DeLegge MH, Holcombe B, Mueller C, Ochoa J, Smith KR. The A.S.P.E.N. nutrition support practice manual 2nd ed. Silver Spring: American Society for Parenteral and Enteral Nutrition; 2005;433-45.
- 7. Baker SS, Baker RD, Davis AM. Pediatric nutrition support. Sudbury: Jones & Bartlett Learning; 2007.
- 8. Papadopoulou A. Nutritional considerations in children undergoing bone marrow transplantation. Eur J Clin Nutr 1998;52(12):863-71. ArticlePubMedPDF
- 9. Fuji S, Einsele H, Savani BN, Kapp M. Systematic nutritional support in allogeneic hematopoietic stem cell transplant recipients. Biol Blood Marrow Transplant 2015;21(10):1707-13. ArticlePubMed
- 10. Bassim CW, Fassil H, Dobbin M, Steinberg SM, Baird K, Cole K, et al. Malnutrition in patients with chronic GVHD. Bone Marrow Transplant 2014;49(10):1300-6. ArticlePubMedPMCPDF
- 11. Correia MI, Waitzberg DL. The impact of malnutrition on morbidity, mortality, length of hospital stay and costs evaluated through a multivariate model analysis. Clin Nutr 2003;22(3):235-9. ArticlePubMed
- 12. Deeg HJ, Seidel K, Bruemmer B, Pepe MS, Appelbaum FR. Impact of patient weight on non-relapse mortality after marrow transplantation. Bone Marrow Transplant 1995;15(3):461-8. PubMed
- 13. Martin-Salces M, de Paz R, Canales MA, Mesejo A, Hernandez- Navarro F. Nutritional recommendations in hematopoietic stem cell transplantation. Nutrition 2008;24(7-8):769-75. ArticlePubMed
- 14. Weisdorf SA, Lysne J, Wind D, Haake RJ, Sharp HL, Goldman A, et al. Positive effect of prophylactic total parenteral nutrition on long-term outcome of bone marrow transplantation. Transplantation 1987;43(6):833-8. ArticlePubMed
- 15. Dickson TM, Kusnierz-Glaz CR, Blume KG, Negrin RS, Hu WW, Shizuru JA, et al. Impact of admission body weight and chemotherapy dose adjustment on the outcome of autologous bone marrow transplantation. Biol Blood Marrow Transplant 1999;5(5):299-305. ArticlePubMed
- 16. Baumgartner A, Bargetzi M, Bargetzi A, Zueger N, Medinger M, Passweg J, et al. Nutritional support practices in hematopoietic stem cell transplantation centers:a nationwide comparison. Nutrition 2017;35:43-50. ArticlePubMed
- 17. Park HJ, Yoon JA, Kim DY, Huh YJ, Chung SY, In YW, et al. Factors associated with length of hospital stay in pediatric hematopoietic stem cell transplantation patients administrating parenteral nutrition. J Korean Soc Parenter Enter Nutr 2011;4(1):1-6. Article
- 18. August DA, Huhmann MB. A.S.P.E.N. clinical guidelines:nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation. JPEN J Parenter Enteral Nutr 2009;33(5):472-500. ArticlePubMedPDF
- 19. White M, Murphy AJ, Hastings Y, Shergold J, Young J, Montgomery C, et al. Nutritional status and energy expenditure in children pre-bone-marrow-transplant. Bone Marrow Transplant 2005;35(8):775-9. ArticlePubMedPDF
- 20. Sharma TS, Bechard LJ, Feldman HA, Venick R, Gura K, Gordon CM, et al. Effect of titrated parenteral nutrition on body composition after allogeneic hematopoietic stem cell transplantation in children:a double-blind, randomized, multicenter trial. Am J Clin Nutr 2012;95(2):342-51. ArticlePubMed
- 21. Fuji S, Mori T, Khattry N, Cheng J, Do YR, Yakushijin K, et al. Severe weight loss in 3 months after allogeneic hematopoietic SCT was associated with an increased risk of subsequent non-relapse mortality. Bone Marrow Transplant 2015;50(1):100-5. ArticlePubMedPDF
- 22. Gibson RS. Principles of nutritional assessment. Oxford: Oxford University Press; 2005.
- 23. Blackburn GL, Bistrian BR, Maini BS, Schlamm HT, Smith MF. Nutritional and metabolic assessment of the hospitalized patient. JPEN J Parenter Enteral Nutr 1977;1(1):11-22. ArticlePubMed
- 24. Rahman MZ, Begum BA. Serum total protein, albumin and A/G ratio in different grades of protein energy malnutrition. Mymensingh Med J 2005;14(1):38-40. PubMed
- 25. Lenssen P, Sherry ME, Cheney CL, Nims JW, Sullivan KM, Stern JM, et al. Prevalence of nutrition-related problems among long-term survivors of allogeneic marrow transplantation. J Am Diet Assoc 1990;90(6):835-42. ArticlePubMed
- 26. Horsley P, Bauer J, Gallagher B. Poor nutritional status prior to peripheral blood stem cell transplantation is associated with increased length of hospital stay. Bone Marrow Transplant 2005;35(11):1113-6. ArticlePubMedPDF
- 27. Layton PB, Gallucci BB, Aker SN. Nutritional assessment of allogeneic bone marrow recipients. Cancer Nurs 1981;4(2):127-34. ArticlePubMed
- 28. Kyle UG, Genton L, Pichard C. Hospital length of stay and nutritional status. Curr Opin Clin Nutr Metab Care 2005;8(4):397-402. ArticlePubMed
- 29. Pichard C, Kyle UG, Morabia A, Perrier A, Vermeulen B, Unger P. Nutritional assessment:lean body mass depletion at hospital admission is associated with an increased length of stay. Am J Clin Nutr 2004;79(4):613-8. ArticlePubMed
- 30. Mullen JL. Complications of total parenteral nutrition in the cancer patient. Cancer Treat Rep 1981;65(Suppl 5):107-13.
References
Figure & Data
REFERENCES
Citations

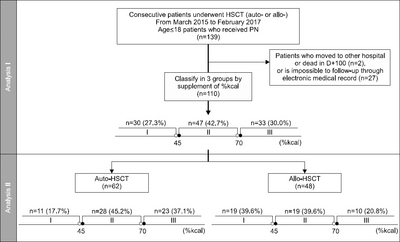
Fig. 1
General characteristics of patients at the time of HSCT (D-1) (n=110)
| Characteristic | Group I (n=30) | Group II (n=47) | Group III (n=33) | P-value |
|---|---|---|---|---|
| Patients | 30 (27.3) | 47 (42.7) | 33 (30.0) | |
| Sex | 0.650 | |||
| Male | 21 (70.0) | 28 (59.6) | 21 (63.6) | |
| Female | 9 (30.0) | 19 (40.4) | 12 (36.4) | |
| Age (y) | 13 (1.0∼17.0) | 4.5 (0.0∼18.0) | 3.5 (0.0∼17.0) | 0.002 |
| Group of age (y) | <0.001 |
|||
| Neonate & infant (0≤y<2) | 2 (6.7) | 4 (8.5) | 9 (27.3) | |
| Early childhood (2≤y<6) | 8 (26.7) | 22 (46.8) | 12 (36.4) | |
| Middle childhood (6≤y<12) | 2 (6.7) | 12 (25.5) | 7 (21.2) | |
| Early adolescence (12≤y<19) | 18 (60.0) | 9 (19.1) | 5 (15.2) | |
| Body weight (kg) | 44.0 (10.5∼67.6) | 18.1 (9.5∼72.5) | 15.6 (7.5∼-57.5) | <0.001 |
| %IBW (%) |
97.8 (67.4∼171.8) | 101.1 (71.6∼135.8) | 98.1 (27.5∼146.8) | 0.710 |
| BMI (kg/m2) |
18.9 (15.1∼28.1) | 16.5 (13.0∼24.2) | 16.2 (13.6∼22.7) | 0.013 |
| Type of parenteral nutrition | 0.406 | |||
| 2-in-1 (glucose based) | 2 (6.7) | 2 (4.3) | 4 (12.1) | |
| 3-in-1 (lipid based) | 28 (93.3) | 45 (95.7) | 29 (87.9) | |
| ROCS | 37.0 (3.0∼44.0) | 54.0 (45.0∼69.0) | 87.0 (71.0∼121.0) | <0.001 |
| Primary disease | 0.035 |
|||
| ALL | 9 (30.0) | 12 (25.5) | 2 (6.1) | |
| AML | 7 (23.3) | 7 (14.9) | 2 (6.1) | |
| CML | 1 (3.3) | 0 (0.0) | 0 (0.0) | |
| Malignant lymphoma | 2 (6.7) | 1 (2.1) | 1 (3.0) | |
| Ewing’s sarcoma | 1 (3.3) | 0 (0.0) | 1 (3.0) | |
| Wilms’ tumor | 0 (0.0) | 1 (2.1) | 3 (9.1) | |
| Brain tumor | 3 (10.0) | 11 (23.4) | 14 (42.4) | |
| Neuroblastoma | 2 (6.7) | 8 (17.0) | 3 (9.1) | |
| Aplastic anemia | 3 (10.0) | 1 (2.1) | 5 (15.2) | |
| Rhabdomyosarcoma | 2 (6.7) | 5 (10.6) | 1 (3.0) | |
| Etc. | 0 (0.0) | 1 (2.1) | 1 (3.0) | |
| Graft type | 0.026a | |||
| Autologous HSCT | 11 (36.7) | 28 (59.6) | 23 (69.7) | |
| Allogeneic HSCT | 19 (63.3) | 19 (40.4) | 10 (30.3) | |
| Stem cell source | 0.043a | |||
| Peripheral blood | 22 (73.3) | 42 (89.4) | 31 (93.9) | |
| Bone marrow | 8 (26.7) | 5 (10.6) | 2 (6.1) |
Values are presented as number (%) or median (range).
HSCT = hematopoietic stem cell transplantation; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; %IBW = %ideal body weight; BMI = body mass index; ROCS = ratio of daily calorie supplementation to the daily calorie requirement; ALL = acute lymphocytic leukemia; AML = acute malignant leukemia; CML = chronic malignant leukemia.
aP<0.05.
b%IBW (%)=(body weight)/(IBW)×100.
cBMI (kg/m2)=(body weight)/(height)2.
Laboratory data at the time of HSCT (D-1)
| Serum concentration | Group I (n=30) | Group II (n=47) | Group III (n=33) | P-value |
|---|---|---|---|---|
| Total protein (g/dL) | 5.9 (4.8~8.5) | 5.8 (4.3~6.8) | 5.8 (1.2~6.7) | 0.693 |
| Albumin (g/dL) | 3.8 (3.2~4.9) | 3.8 (2.8~4.4) | 3.8 (2.9~4.3) | 0.839 |
| Total bilirubin (mg/dL) | 0.6 (0.1~4.8) | 0.3 (0.1~1.6) | 0.3 (0.1~1.4) | 0.012 |
| Direct bilirubin (mg/dL) | 0.2 (0.1~1.1) | 0.1 (0.1~0.7) | 0.1 (0.1~0.6) | 0.043 |
| AST (IU/L) | 38.5 (10.0~711) | 47.0 (12.0~265) | 48.5 (16.0~421) | 0.832 |
| ALT (IU/L) | 35.0 (14.0~884) | 54.5 (9.0~213) | 39.0 (9.0~210) | 0.705 |
| Glucose (mg/dL) | 105 (75.0~360) | 99.0 (71.0~318) | 98.0 (79.0~155) | 0.281 |
| Cholesterol (mg/dL) | 149.5 (72.0~235) | 147.5 (96.0~300) | 138.5 (89.0~207) | 0.138 |
Values are presented as median (range).
HSCT = hematopoietic stem cell transplantation; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal~<70%kcal; Group III = ≥70%kcal; AST = aspartate aminotransferase; ALT = alanine aminotransferase.
aP<0.05.
Analysis of variation in the factors related with nutritional status from D-1 to last-PN day
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value |
|---|---|---|---|---|---|---|
| Percentile of ΔBW |
–3.9 (–16.3~+7.6)/47.8 | –1.5 (–23.6~+8.2)/55.5 | –0.4 (–40~+4.6)/62.5 | 0.186 | 0.056 | +1.907 |
| Δ%Ideal body weight |
–4.0 (–17.2~+9.6)/48.6 | –1.4 (–23.8~+7.8)/55.7 | –0.8 (–39.3~+4.9)/61.6 | 0.270 | 0.090 | +1.696 |
| ΔBody mass index |
–7.6 (–3.2~+2.0)/47.9 | –0.3 (–5.0~+1.5)/56.2 | –0.2 (–6.2~+0.8)/61.5 | 0.230 | 0.078 | +1.763 |
| ΔTotal protein |
0.3 (–1.2~+1.9)/50.5 | 0.4 (–1.8~+2.1)/57.2 | 0.8 (–2.1~+4.8)/57.6 | 0.603 | 0.361 | +0.914 |
| ΔAlbumin |
–0.2 (–0.9~+0.8)/48.7 | –0.1 (–1.4~+1.0)/58.0 | –0.1 (–1.9~+0.9)/58.1 | 0.391 | 0.243 | +1.168 |
Values are presented as median (range)/mean rank.
D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal~<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; BW = body weight.
aPercentile of ΔBW (%)=[{(BW of last–PN day)–(BW of D-1)}/(BW of D-1)]×100.
bΔdata=(data of last–PN day)–(data of D-1).
Analysis of variation in the factors related with clinical early outcome from D-1 to last-PN day
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value | P-value | I vs. II P-value | I vs. III P-value | II vs. III P-value |
|---|---|---|---|---|---|---|---|---|---|---|
| Duration of PN administration (d) | 21.5 (8.0∼98.0)/67.1 | 18.5 (9.0∼155.0)/56.1 | 17.0 (1.0∼41.0)/44.2 | 0.017 |
0.005 |
–2.271 | ||||
| Length of hospital stay (d) | 32.0 (23.0∼194.0)/66.3 | 30.5 (17.0∼175.0)/54.1 | 30.0 (15.0∼82.0)/47.7 | 0.063 | 0.023 |
–2.840 | ||||
| Engraft day (d) | 15.5 (9.0 ~+22.0)/72.0 | 12.0 (10.0 ~+93.0)/54.0 | 12.0 (9.0 ~+19.0)/42.7 | 0.001 |
<0.001 |
–3.695 | ||||
| GVHD | 6 (20.0) | 9 (19.1) | 3 (9.1) | 0.400 | ||||||
| Sepsis | 4 (13.3) | 7 (14.9) | 3 (9.1) | 0.740 | ||||||
| Pneumonia | 8 (26.7) | 14 (29.8) | 5 (15.2) | 0.310 | ||||||
| Mucositis | 15 (50.0) | 22 (46.8) | 13 (39.4) | 0.679 | ||||||
| Analysis of statistically significant differences between 2-groups by Mann-Whitney test, mean rank | ||||||||||
| Duration of PN administration (d) | 43.6 | 36.1 | 0.149 | |||||||
| 39.0 | 25.6 | 0.004 |
||||||||
| 44.0 | 35.5 | 0.108 | ||||||||
| Engraft day (d) | 46.9 | 33.9 | 0.012 |
|||||||
| 40.6 | 24.2 | <0.001 |
||||||||
| 44.1 | 35.4 | 0.098 | ||||||||
Values are presented as median (range)/mean rank, number (%), or mean rank only.
D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; GVHD = graft-versus-host disease.
aP<0.05.
bStatistically significant when P<0.017 in Mann-Whitney test.
Analysis of factors related with PN complications from D-1 to last-PN day
| Variable | Group I (n=30) | Group II (n=47) | Group III (n=33) | K-W P-value | J-T P-value | J-T z-value | P-value | I vs. II P-value | I vs. III P-value | II vs. III P-value |
|---|---|---|---|---|---|---|---|---|---|---|
| ΔTotal bilibulin (mg/dL) |
0.8 (0.0∼32.4)/71.1 | 0.4 (0.0∼54.5)/54.9 | 0.2 (0.0∼5.3)/42.2 | 0.001 |
<0.001 |
–3.660 | ||||
| ΔDirect bilibulin (mg/dL) |
0.3 (0.0∼26.2)/64.1 | 0.1 (0.6∼+42.1)/51.9 | 0.0 (–0.4∼+4.4)/40.8 | 0.011 |
0.002 |
–3.064 | ||||
| ΔAST (IU/L) |
30.5 (–3.0∼+2353.0)/61.3 | 20.5 (0.0∼+1294.0)/55.4 | 19.0 (0.0∼+2134.0)/50.3 | 0.388 | 0.177 | –1.349 | ||||
| ΔALT (IU/L) |
31.0 (0.0∼+1400.0)/60.7 | 16.0 (–11.0∼+1274.0)/55.9 | 12.0 (0.0∼+1001.0)/50.2 | 0.419 | 0.197 | –1.291 | ||||
| ΔGlucose (mg/dL) |
42.5 (0.0∼248.0)/49.5 | 69.5 (0.0∼474.0)/63.2 | 43 (0.0∼801.0)/50.0 | 0.089 | 0.999 | <0.001 | ||||
| ΔCholesterol (mg/dL) |
25.5 (–4.0∼+157.0)/52.6 | 33.0 (0.0∼212.0)/56.7 | 34.5 (0.0∼87.0)/56.4 | 0.837 | 0.658 | +0.443 | ||||
| VOD development | 8 (26.7) | 10 (21.3) | 3 (9.1) | 0.183 | ||||||
| Analysis of statistically significant differences between 2-groups by Mann-Whitney test, mean rank | ||||||||||
| ΔTotal bilibulin (mg/dL) |
46.3 | 34.4 | 0.022 | |||||||
| 40.3 | 24.4 | 0.001 |
||||||||
| 44.6 | 34.7 | 0.060 | ||||||||
| ΔDirect bililubin (mg/dL) |
40.4 | 32.2 | 0.094 | |||||||
| 37.2 | 24.6 | 0.004 |
||||||||
| 41.2 | 32.6 | 0.078 | ||||||||
Values are presented as median (range)/mean rank, number(%), or mean rank only.
PN = parenteral nutrition; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; AST = aspartate aminotransferase; ALT = alanine aminotransferase; VOD = hepatic veno-occlusive disease.
aP<0.05.
bΔdata=(maximum data from D-1 to last–PN day)–(data of D-1).
cStatistically significant when P<0.017 in Mann-Whitney test.
Values are presented as number (%) or median (range). HSCT = hematopoietic stem cell transplantation; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; %IBW = %ideal body weight; BMI = body mass index; ROCS = ratio of daily calorie supplementation to the daily calorie requirement; ALL = acute lymphocytic leukemia; AML = acute malignant leukemia; CML = chronic malignant leukemia. P<0.05. %IBW (%)=(body weight)/(IBW)×100. BMI (kg/m2)=(body weight)/(height)2.
Values are presented as median (range). HSCT = hematopoietic stem cell transplantation; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal~<70%kcal; Group III = ≥70%kcal; AST = aspartate aminotransferase; ALT = alanine aminotransferase. P<0.05.
Values are presented as median (range)/mean rank. D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal~<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; BW = body weight. Percentile of ΔBW (%)=[{(BW of last–PN day)–(BW of D-1)}/(BW of D-1)]×100. Δdata=(data of last–PN day)–(data of D-1).
Values are presented as median (range)/mean rank, number (%), or mean rank only. D-1 = the day before transplantation day; PN = parenteral nutrition; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; GVHD = graft-versus-host disease. P<0.05. Statistically significant when P<0.017 in Mann-Whitney test.
Values are presented as median (range)/mean rank, number(%), or mean rank only. PN = parenteral nutrition; D-1 = the day before transplantation day; Group I = <45%kcal; Group II = ≥45%kcal∼<70%kcal; Group III = ≥70%kcal; K-W = Kruskal-Wallis test; J-T = Jonckheere-Terpstra test; AST = aspartate aminotransferase; ALT = alanine aminotransferase; VOD = hepatic veno-occlusive disease. P<0.05. Δdata=(maximum data from D-1 to last–PN day)–(data of D-1). Statistically significant when P<0.017 in Mann-Whitney test.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

