Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > J Clin Nutr > Volume 12(2); 2020 > Article
- Original Article Comparison of Energy Requirements of Patients with Brain Injury of the Intensive Care Unit: Indirect Calorimetry <i>vs</i>. Predictive Equations
-
EunJoo Bae1,4
 , SeongSuk Kang2
, SeongSuk Kang2 , MiYeon Kim2
, MiYeon Kim2 , JinYoung Jang3
, JinYoung Jang3 , HyunJung Lim4
, HyunJung Lim4 , TaeGon Kim3
, TaeGon Kim3
- 뇌손상 중환자의 에너지 요구량 비교: 간접열량측정기 <i>vs</i> 예측방정식
-
배은주1,4
 , 강성숙2
, 강성숙2 , 김미연2
, 김미연2 , 장진영3
, 장진영3 , 임현정4
, 임현정4 , 김태곤3
, 김태곤3
-
Journal of Clinical Nutrition 2020;12(2):41-47.
DOI: https://doi.org/10.15747/jcn.2020.12.2.41
Published online: December 31, 2020
1Nutrition Support Team, CHA Bundang Medical Center, CHA University School of Medicine, Seongnam, Korea
2Department of Nursing, CHA Bundang Medical Center, CHA University School of Medicine, Seongnam, Korea
3Department of Neurosurgery, CHA Bundang Medical Center, CHA University School of Medicine, Seongnam, Korea
4Department of Medical Nutrition, Research Institute of Medical Nutrition, Kyung Hee University, Yongin, Korea
- Correspondence to TaeGon Kim https://orcid.org/0000-0001-6258-6412 Department of Neurosurgery, CHA Bundang Medical Center, CHA University School of Medicine, 59 Yatap-ro, Bundang-gu, Seongnam 13496, Korea Tel: +82-31-780-5260, Fax: +82-31-780-5269, E-mail: tgkim@chamc.co.kr
- HyunJung Lim https://orcid.org/0000-0001-7632-7315 Department of Medical Nutrition, Research Institute of Medical Nutrition, Kyung Hee University, 1732 Deokyeong-daero, Giheung-gu, Yongin 17104, Korea Tel: +82-31-201-2343, Fax: +82-2-969-7717, E-mail: hjlim@khu.ac.kr
© 2020, The Korean Society for Parenteral and Enteral Nutrition. All Rights Reserved.
This is an open-access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 968 Views
- 7 Download
Abstract
-
Purpose The metabolic activity and demand usually increase in seriously ill patients, especially in patients with a brain injury (BI). These nutritional demands have been traditionally satisfied using predictive equations (PEs). Recently, indirect calorimetry (IC) has been used widely because it is more accurate than other methods. This study measured the energy expenditures (EE) using IC (GE, CARESCAPE B650, Helsinki, Finland) and calculated the PEs simultaneously in patients with BI.
-
Methods This study was conducted on 55 patients with a BI for three years (2017.7∼2020.8), who were mechanically ventilated within a hospital for ≤seven days. The EE values using IC were measured once in each patient, and the EE values using PE were calculated using 5 PEs (ESPEN, Harris-Benedict, HB; Frankenfield, FK; Penn state, PS; and Faisy) at the same time. The 55 patients were divided into two groups, acute group (39 patients; ≤3 hospital days group, AG) and subacute group (16 patients; >3 hospital days group, SG) according to the time, and the values were obtained.
-
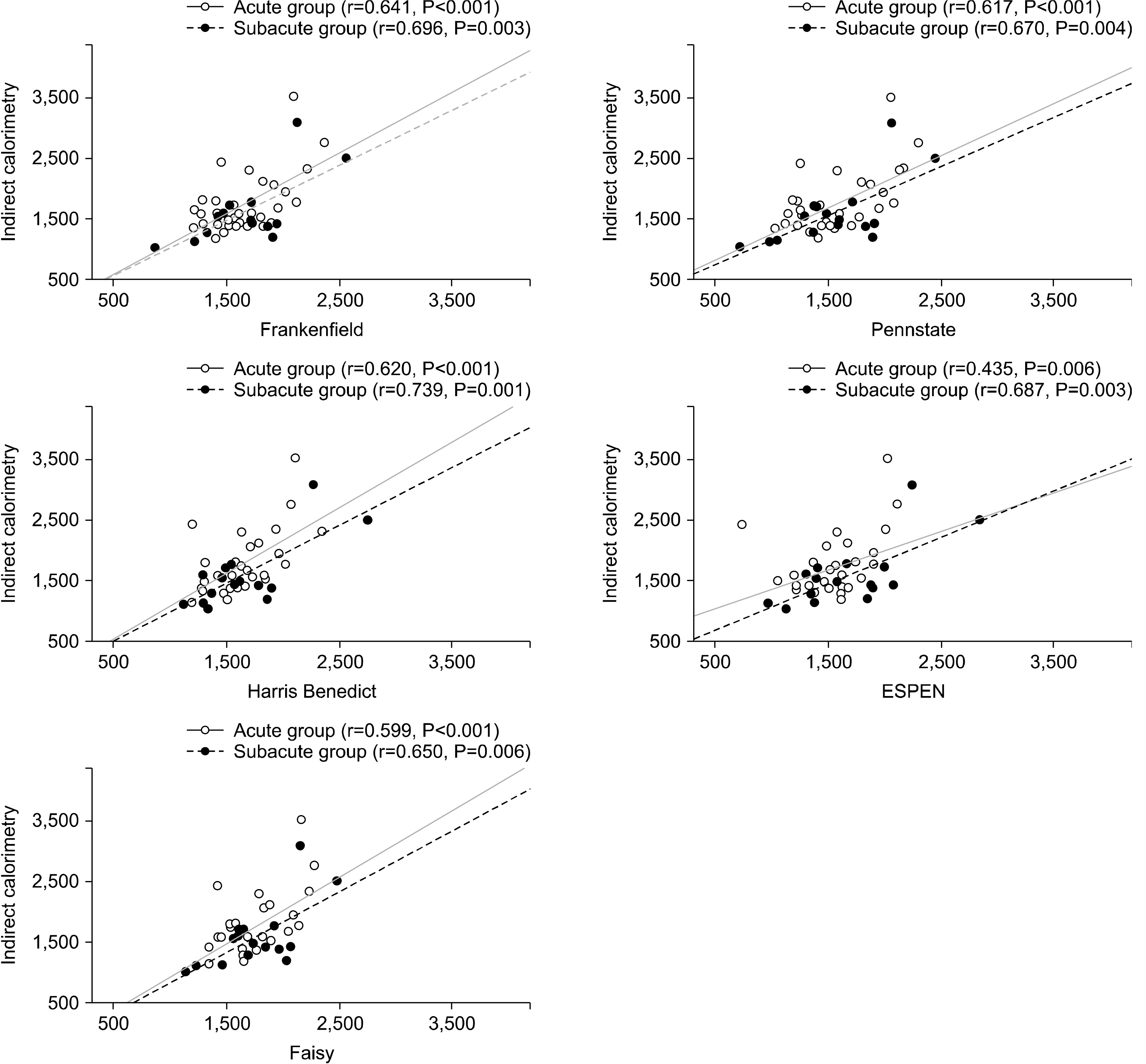
Results There were no differences in the patient’s characteristics between the two groups, including age, gender, severity of the condition (Simplified Acute Physiology Score II), and anthropometric parameters. In AG, the energy expenditure values using PEs were significantly lower than those using IC in the three PEs (IC 1,712.0±476 kcal, ESPEN 1,558.6±324 kcal, P=0.038, HB 1,582.4±273 kcal, P=0.037, PS 1,530.8±340 kcal, P=0.005). In SG, the EE value using PEs did not differ significantly from that using IC.
-
Conclusion An accurate assessment of EE is critical for seriously ill patients. These results showed that the previously well-known PEs might not be correct, particularly in acute patients with BI. Therefore, it is recommended that the EE values be obtained using IC, at least in acute patients with BI.
서 론
대상 및 방법
1) 임상적 자료
2) 간접열량측정
3) 예측 방정식
4) 통계적 분석
결 과
고 찰
결 론
Values are presented as number only, number (%), or mean±standard deviation.
AG = acute group; SG = subacute group; SAPS II = Simplified Acute Physiology Score; PEEP = positive end expiratory pressure breathing; IC = indirect calorimetry; EN = enteral nutrition; PN = parenteral nutrition.
Parametric data used two sample t-test by P-value <0.05.
Nutrition regimen and diagnosis used chi-square test by P-value <0.05.
| EE | AG (n=39) | SG (n=16) | |||||
|---|---|---|---|---|---|---|---|
|
|
|
||||||
| Mean±SD (kcal/d) | Difference averagesa | P-value | Mean±SD (kcal/d) | Difference averagesa | P-value | ||
| Estimated energy | IC | 1,712.0±476 | 1,590.2±531 | ||||
| Predictive equations | ESPEN | 1,558.6±324 | 153.3±444.4 | 0.038* | 1,683.4±475 | –93.1±401.7 | 0.368 |
| HB | 1,582.4±273 | 129.5±374.2 | 0.037* | 1,635.8±409 | –45.5±358.6 | 0.619 | |
| FK | 1,625.9±306 | 86.0±365.4 | 0.149 | 1,633.1±406 | –42.8±383.6 | 0.662 | |
| PS | 1,530.8±340 | 181.1±377.4 | 0.005* | 1,542.7±436 | 47.5±402.3 | 0.643 | |
| Faisy | 1,719.9±259 | –7.9±382.2 | 0.897 | 1,756.4±344 | –166.1±403.9 | 0.121 | |
- 1. Annette H, Wenström Y. 2005;Implementing clinical guidelines for nutrition in a neurosurgical intensive care unit. Nurs Health Sci 7(4):266-72. ArticlePubMed
- 2. Turan N, Kaya H. 2014;Management of constipation in neurosurgery patients. J Neurol Neurosurg Nurs 3(2):81-7. ArticlePDF
- 3. Zarbock SD, Steinke D, Hatton J, Magnuson B, Smith KM, Cook AM. 2008;Successful enteral nutritional support in the neurocritical care unit. Neurocrit Care 9(2):210-6. ArticlePubMedPDF
- 4. Clifton GL, Robertson CS, Grossman RG, Hodge S, Foltz R, Garza C. 1984;The metabolic response to severe head injury. J Neurosurg 60(4):687-96. ArticlePubMed
- 5. Faisy C, Guerot E, Diehl JL, Labrousse J, Fagon JY. 2003;Assessment of resting energy expenditure in mechanically ventilated patients. Am J Clin Nutr 78(2):241-9. ArticlePubMed
- 6. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, et al. 2006;ESPEN guidelines on enteral nutrition: intensive care. Clin Nutr 25(2):210-23. ArticlePubMed
- 7. Frankenfield D, Smith JS, Cooney RN. 2004;Validation of 2 approaches to predicting resting metabolic rate in critically ill patients. JPEN J Parenter Enteral Nutr 28(4):259-64. ArticlePubMed
- 8. Frankenfield DC, Omert LA, Badellino MM, Wiles CE 3rd, Bagley SM, Goodarzi S, et al. 1994;Correlation between measured energy expenditure and clinically obtained variables in trauma and sepsis patients. JPEN J Parenter Enteral Nutr 18(5):398-403. ArticlePubMed
- 9. McClave SA, Martindale RG, Kiraly L. 2013;The use of indirect calorimetry in the intensive care unit. Curr Opin Clin Nutr Metab Care 16(2):202-8. ArticlePubMed
- 10. Graf S, Karsegard VL, Viatte V, Heidegger CP, Fleury Y, Pichard C, et al. 2015;Evaluation of three indirect calorimetry devices in mechanically ventilated patients: which device compares best with the Deltatrac II(®)? A prospective observational study. Clin Nutr 34(1):60-5. ArticlePubMed
- 11. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. 2019;ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 38(1):48-79. ArticlePubMed
- 12. Brandi LS, Grana M, Mazzanti T, Giunta F, Natali A, Ferrannini E. 1992;Energy expenditure and gas exchange measurements in postoperative patients: thermodilution versus indirect calorimetry. Crit Care Med 20(9):1273-83. ArticlePubMed
- 13. Kim SH, Cho BH, Kim SB, Jeong MJ, Yu HC. 2017;Determination of the stress factor calculated from the changes in the measured resting energy expenditure with indirect calorimetry in patients undergoing pancreaticoduodenectomy. J Clin Nutr 9(2):62-7. Article
- 14. Matarese LE, Gottschlich MM. 1998. Contemporary nutrition support practice: a clinical guide. W.B. Saunders; Philadelphia.Article
- 15. Roza AM, Shizgal HM. 1984;The Harris Benedict equation reevaluated: resting energy requirements and the body cell mass. Am J Clin Nutr 40(1):168-82. ArticlePubMed
- 16. Bitzani M, Matamis D, Nalbandi V, Vakalos A, Karasakalides A, Riggos D. 1999;Resting energy expenditure in brain death. Intensive Care Med 25(9):970-6. ArticlePubMedPDF
- 17. Hadfield JM, Little RA, Jones RA. 1992;Measured energy expenditure and plasma substrate and hormonal changes after severe head injury. Injury 23(3):177-82. ArticlePubMed
- 18. Wilson RF, Tyburski JG. 1998;Metabolic responses and nutritional therapy in patients with severe head injuries. J Head Trauma Rehabil 13(1):11-27. ArticlePubMed
- 19. Kolpek JH, Ott LG, Record KE, Rapp RP, Dempsey R, Tibbs P, et al. 1989;Comparison of urinary urea nitrogen excretion and measured energy expenditure in spinal cord injury and nonsteroid-treated severe head trauma patients. JPEN J Parenter Enteral Nutr 13(3):277-80. ArticlePubMed
- 20. Nagano A, Yamada Y, Miyake H, Domen K, Koyama T. 2015;Comparisons of predictive equations for resting energy expenditure in patients with cerebral infarct during acute care. J Stroke Cerebrovasc Dis 24(8):1879-85. ArticlePubMed
- 21. Ashcraft CM, Frankenfield DC. 2013;Energy expenditure during barbiturate coma. Nutr Clin Pract 28(5):603-8. ArticlePubMedPDF
- 22. Graf S, Pichard C, Genton L, Oshima T, Heidegger CP. 2017;Energy expenditure in mechanically ventilated patients: the weight of body weight! Clin Nutr 36(1):224-8. ArticlePubMed
- 23. Frankenfield DC, Coleman A, Alam S, Cooney RN. 2009;Analysis of estimation methods for resting metabolic rate in critically ill adults. JPEN J Parenter Enteral Nutr 33(1):27-36. ArticlePubMedPDF
- 24. Frankenfield DC, Ashcraft CM, Galvan DA. 2012;Longitudinal prediction of metabolic rate in critically ill patients. JPEN J Parenter Enteral Nutr 36(6):700-12. ArticlePubMedPDF
- 25. Singer P, Anbar R, Cohen J, Shapiro H, Shalita-Chesner M, Lev S, et al. 2011;The tight calorie control study (TICACOS): a prospective, randomized, controlled pilot study of nutritional support in critically ill patients. Intensive Care Med 37(4):601-9. ArticlePubMedPDF
- 26. Vermeij CG, Feenstra BW, van Lanschot JJ, Bruining HA. 1989;Day-to-day variability of energy expenditure in critically ill surgical patients. Crit Care Med 17(7):623-6. ArticlePubMed
References
Figure & Data
REFERENCES
Citations

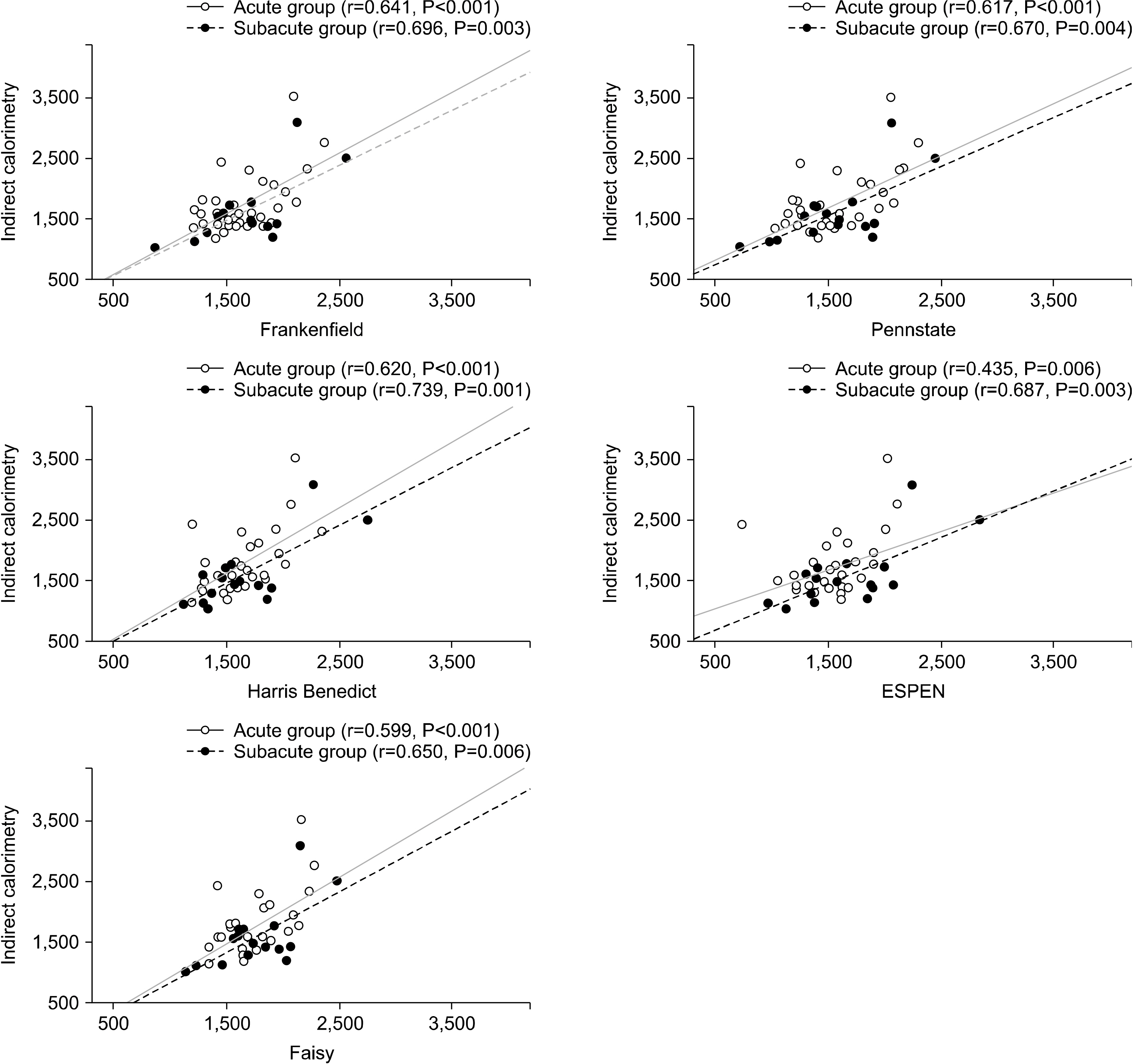
Fig. 1
Predictive equations used to obtain the estimates of energy expenditure
| Equation name | Calculation of energy expenditure |
|---|---|
| ESPEN | Weight (kg)×25 kcal/kg |
| HB | HB-BEE×Activity factor×Stress factor |
| HB-BEE : Men=66.4+13.7 (weight)+5.0 (height)–6.8 (age) | |
| Women=655+9.6 (weight)+1.8 (height)–4.7 (age) | |
| FK | HB-BEE (0.85)+Tmax× (175)+MV×(33)–6,344 |
| MV: minute ventilation=(Respiratory rate×Tidal Volume)/1,000 | |
| PS | MF (0.96)+Tmax× (167)+MV× (32) –6,212 |
| MF: Men=5+10 (weight)+6.25 (height)–5 (age) | |
| Women=–161+10 (weight)+6.25 (height)–5 (age) | |
| Faisy | (8×weight)+(14× height)+(32×MV)+(94×Tmax)–4,834 |
ESPEN = European Society for Clinical Nutrition and Metabolism; HB = Harris Benedict; HB-BEE = Harris Benedict-Basal energy expenditure; FK = FranKenfield; Tmax = maximum body temperature; MV = Minute Ventilation; PS = Penn state; MF = Mifflin formula.
Comparison of patient’s anthropometric and clinical characteristics
| All (n=55) | AG (n=39) | SG (n=16) | P-values | |
|---|---|---|---|---|
| Age (y) | 60.1±15.0 | 58±14 | 58±20 | 0.219 |
| Sex (Male:Female) | 24:31 | 16:23 | 8:8 | 0.542 |
| Height (cm) | 162.7±8.5 | 162.4±8.0 | 163.4±9.7 | 0.721 |
| Body Mass Index (kg/m2) | 23.9±4.3 | 23.5±3.8 | 24.9±5.3 | 0.274 |
| SAPS II(point) | 35.6±13.6 | 35.8±14.5 | 35.0±11.5 | 0.832 |
| Glasgow Coma Scale (point) | 5.6±2.7 | 5.7±2.8 | 5.4±2.5 | 0.692 |
| Inspired fraction of oxygen (%) | 35.3±6.3 | 35.4±6.0 | 35.1±0.7 | 0.892 |
| PEEP (cmH2O) | 4.7±0.4 | 4.8±0.3 | 4.7±0.5 | 0.681 |
| Body temperature (℃) | 37.7±0.8 | 37.7±0.8 | 37.6±0.8 | 0.472 |
| Heart rate (pulse) | 80.8±17.2 | 82.9±17.9 | 75.5±14.7 | 0.146 |
| Respiratory rate (breaths/min) | 14.9±2.5 | 14.9±2.4 | 14.8±2.9 | 0.924 |
| IC Measured day | 2.8±1.5 | 2.0±0.7 | 4.7±1.1 | 0.014* |
| Nutrition regimen during IC | 0.034* | |||
| EN | 17 (30.9) | 9 (23.1) | 8 (50.0) | |
| PN | 6 (10.9) | 3 (7.7) | 3 (18.8) | |
| EN+PN | 32 (58.2) | 27 (69.2) | 5 (31.3) | |
| Diagnosis | 0.444 | |||
| Intracerebral hemorrhage | 26 (47.3) | 18 (46.2) | 8 (50.0) | |
| Subarachnoid hemorrhage | 13 (23.6) | 10 (25.6) | 3 (18.8) | |
| Subdural hemorrhage | 7 (12.7) | 3 (7.7) | 4 (25.0) | |
| Intracranial hemorrhage | 5 (9.1) | 4 (80.0) | 1 (6.3) | |
| Epidural hemorrhage | 2 (3.6) | 2 (5.1) | 0 (0) | |
| Cerebral aneurysm | 2 (3.6) | 2 (5.1) | 0 (0) | |
| Operation | 0.868 | |||
| Yes | 52 (94.5) | 37 (94.9) | 15 (93.7) | |
| No | 3 (5.5) | 2 (5.1) | 1 (6.3) |
Values are presented as number only, number (%), or mean±standard deviation.
AG = acute group; SG = subacute group; SAPS II = Simplified Acute Physiology Score; PEEP = positive end expiratory pressure breathing; IC = indirect calorimetry; EN = enteral nutrition; PN = parenteral nutrition.
Parametric data used two sample t-test by P-value <0.05.
Nutrition regimen and diagnosis used chi-square test by P-value <0.05.
Comparisons between the averages for EE by IC and EE by PEs for two groups
| EE | AG (n=39) | SG (n=16) | |||||
|---|---|---|---|---|---|---|---|
| Mean±SD (kcal/d) | Difference averages |
P-value | Mean±SD (kcal/d) | Difference averages |
P-value | ||
| Estimated energy | IC | 1,712.0±476 | 1,590.2±531 | ||||
| Predictive equations | ESPEN | 1,558.6±324 | 153.3±444.4 | 0.038 |
1,683.4±475 | –93.1±401.7 | 0.368 |
| HB | 1,582.4±273 | 129.5±374.2 | 0.037 |
1,635.8±409 | –45.5±358.6 | 0.619 | |
| FK | 1,625.9±306 | 86.0±365.4 | 0.149 | 1,633.1±406 | –42.8±383.6 | 0.662 | |
| PS | 1,530.8±340 | 181.1±377.4 | 0.005 |
1,542.7±436 | 47.5±402.3 | 0.643 | |
| Faisy | 1,719.9±259 | –7.9±382.2 | 0.897 | 1,756.4±344 | –166.1±403.9 | 0.121 | |
AG = acute group; SG = subacute group; EE = energy expenditure; IC = indirect calorimetry; PEs = predictive equations; HB = Harris Benedict; FK = FranKenfield; PS = Penn state.
aDifference averages = EE by IC–EE by PEs.
Comparison of measurements was performed using student t-test. *P<0.05.
ESPEN = European Society for Clinical Nutrition and Metabolism; HB = Harris Benedict; HB-BEE = Harris Benedict-Basal energy expenditure; FK = FranKenfield; Tmax = maximum body temperature; MV = Minute Ventilation; PS = Penn state; MF = Mifflin formula.
Values are presented as number only, number (%), or mean±standard deviation. AG = acute group; SG = subacute group; SAPS II = Simplified Acute Physiology Score; PEEP = positive end expiratory pressure breathing; IC = indirect calorimetry; EN = enteral nutrition; PN = parenteral nutrition. Parametric data used two sample t-test by P-value <0.05. Nutrition regimen and diagnosis used chi-square test by P-value <0.05.
AG = acute group; SG = subacute group; EE = energy expenditure; IC = indirect calorimetry; PEs = predictive equations; HB = Harris Benedict; FK = FranKenfield; PS = Penn state. aDifference averages = EE by IC–EE by PEs. Comparison of measurements was performed using student t-test. *P<0.05.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

