Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 9(2); 2018 > Article
- ORIGINAL ARTICLE Effect of the Remnant Stomach Volume on the Nutritional and Body Composition in Stage 1 Gastric Cancer Patients
- Koen Lee, M.D.1,2,*, Kyung Won Kim, M.D., Ph.D.2,*, Jung-Bok Lee, M.D.3, Yongbin Shin, Ph.D.2, Jin Kyoo Jang, B.A.2, Jeong-Hwan Yook, M.D., Ph.D.1, Byung-Sik Kim, M.D., Ph.D.1, In-Seob Lee, M.D., Ph.D.1
- 1기 위암 환자에서 잔위 용적이 수술 후 영양 상태와 신체 구성에 미치는 영향
- 이고은, M.D.1,2,*, 김경원, M.D., Ph.D.2,*, 이정복, M.D.3, 신용빈, Ph.D.2, 장진규, B.A.2, 육정환, M.D., Ph.D.1, 김병식, M.D., Ph.D.1, 이인섭, M.D., Ph.D.1
-
Surgical Metabolism and Nutrition 2018;9(2):41-50.
DOI: https://doi.org/10.18858/smn.2018.9.2.41
Published online: December 30, 2018
Department of Surgery, Center for Medical Research and Information, Asan Medical Center, University of Ulsan College of Medicine, Seoul, Korea
Department of Radiology and Asan Image Metrics, Center for Medical Research and Information, Asan Medical Center, University of Ulsan College of Medicine, Seoul, Korea
Division of Biostatistics, Center for Medical Research and Information, Asan Medical Center, University of Ulsan College of Medicine, Seoul, Korea
- Correspondence to: In-Seob Lee, Department of Surgery, Asan Medical Center, Ulsan University College of Medicine, 88 Olympic-ro 43-gil, Songpa-gu, Seoul 05505, Korea Tel: +82-2-3010-1728, Fax: +82-2-474-9027, E-mail: inseoblee77@gmail.com
These authors equally contribute to this work as co-first authors.
This research was supported by a grant of the Korean Society of Surgical Metabolism and Nutrition.
Copyright: © The Korean Society of Surgical Metabolism and Nutrition
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 1,006 Views
- 3 Download
- 1 Crossref
Abstract
-
Purpose: During the first year after surgery, gastric cancer patients experience weight loss and a decline in physical activity. In addition, depravation of the nutritional status and anemia is observed. The decrease in stomach volume is believed to be one of the causes for these changes. The purpose of this study was to investigate the effects of the remnant stomach volume on nutrition, anemia, and body composition-related parameters in gastric cancer patients after surgery.
-
Materials and Methods: A total of 110 patients with stage 1 gastric cancer, who underwent a laparoscopic gastrectomy in 2015 were evaluated in this prospective observational study. Among them, 78 patients received a distal gastrectomy (Billroth 1: 52, Billroth 2: 12, Roux en Y: 14) and 32 underwent a total gastrectomy. The weight, height, and blood test results of the patients were collected during the observation period. The remnant stomach volume, total abdominal muscle area, and subcutaneous/visceral fat area were measured using CT images.
-
Results: Patients with a larger remnant stomach volume showed a smaller decrease in the nutritional parameters and better recovery of the hemoglobin level during the first year after surgery. Among the body composition parameters, visceral fat was affected to the greatest extent and subcutaneous/visceral fat were better preserved in the group with a larger remnant stomach volume. In the group with a total gastrectomy, the parameters were worsened significantly compared to the distal gastrectomy group.
-
Conclusion: The remnant stomach volume has a protective effect on the body mass index, body weight change, hemoglobin, total protein, cholesterol, and visceral/subcutaneous fat area during the first year after surgery.
서 론
대상 및 방법
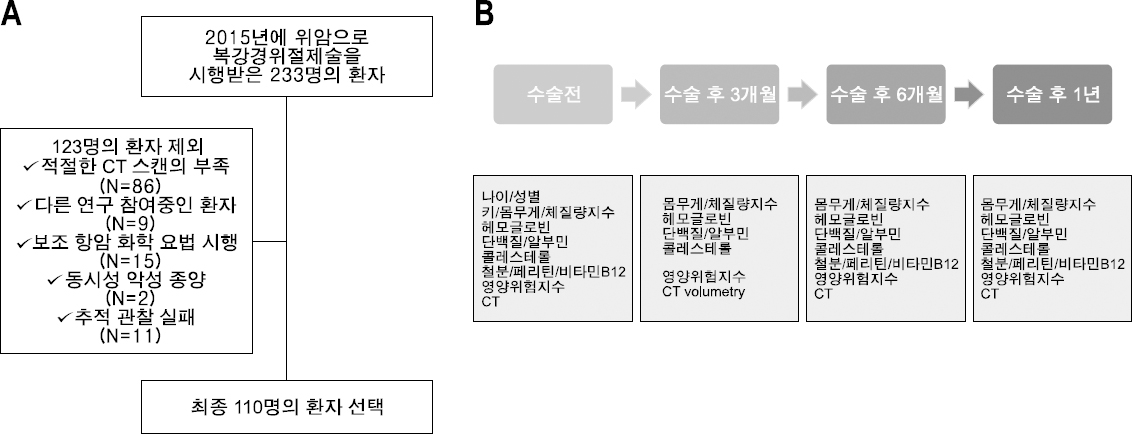
1) 잔위용적 평가
2) 신체구성 계측의 평가
3) 통계학적 분석
결 과
| 특징 | 환자군 | P값 | ||||||
|---|---|---|---|---|---|---|---|---|
|
|
|
|||||||
| 원위절제술 (N=78) | RSV≤200 cm3 (N=28) | 200<RSV≤500 cm3 (N=39) | RSV>500 cm3 (N=11) | 전절제술 (N=32) | P-value1 | P-value2 | ||
| 나이(년) | 57.45±10.66 | 59.86±11.74 | 55.69±9.15 | 57.55±12.46 | 55.22±10.47 | 0.3214 | 0.4991 | |
| 성별(명) | 남 | 47 (60%) | 17 (60%) | 24 (62%) | 6 (55%) | 18 (56%) | 0.9547 | 0.6979 |
| 여 | 31 (40%) | 11 (40%) | 15 (38%) | 5 (45%) | 14 (44%) | |||
| 키(cm) | 162.63±7.67 | 162.50±7.17 | 162.46±7.67 | 163.60±9.46 | 163.14±7.47 | 0.9595 | 0.4978 | |
| 체중(kg) | 63.81±10.24 | 63.96±9.5 | 64.11±10.11 | 62.36±13.13 | 63.49±13.35 | 0.9722 | 0.3796 | |
| 체질량지수(kg/m2) | 24.05±2.99 | 24.18±2.94 | 24.24±3.06 | 23.08±2.91 | 23.67±3.57 | 0.674 | 0.384 | |
| 잔위용적(cm3) | 290.9±201.4 | 116.8±57.04 | 305.0±72.95 | 684.4±165.9 | <.0001* | |||
| 문합법(N) | Billroth 1 | 52 | 13 | 29 | 10 | <.0001 | <.0001 | |
| Billroth 2 | 12 | 8 | 4 | 0 | ||||
| RYGJ | 14 | 7 | 6 | 1 | ||||
1) 단백질/지질 관련 인자
2) 빈혈 관련 인자
고 찰
결 론
- 1. Information Committee of Korean Gastric Cancer Association. Korean Gastric Cancer Association nationwide survey on gastric cancer in 2014. J Gastric Cancer 2016;16:131-40. ArticlePubMedPMCPDF
- 2. Bae JM, Park JW, Yang HK, Kim JP. Nutritional status of gastric cancer patients after total gastrectomy. World J Surg 1998;22:254-60; discussion 260-1. ArticlePubMedPDF
- 3. Katsube T, Konnno S, Murayama M, Kuhara K, Sagawa M, Yoshimatsu K, et al. Changes of nutritional status after distal gastrectomy in patients with gastric cancer. Hepatogastroenterology 2008;55:1864-7. ArticlePubMed
- 4. Kim KH, Park DJ, Park YS, Ahn SH, Park DJ, Kim HH. Actual 5-year nutritional outcomes of patients with gastric cancer. J Gastric Cancer 2017;17:99-109. ArticlePubMedPMCPDF
- 5. Levolger S, van Vugt JL, de Bruin RW, IJzermans JN. Systematic review of sarcopenia in patients operated on for gastrointestinal and hepatopancreatobiliary malignancies. Br J Surg 2015;102:1448-58. ArticlePubMedPDF
- 6. Huang DD, Zhou CJ, Wang SL, Mao ST, Zhou XY, Lou N, et al. Impact of different sarcopenia stages on the postoperative outcomes after radical gastrectomy for gastric cancer. Surgery 2017;161:680-93. ArticlePubMed
- 7. Kuwada K, Kuroda S, Kikuchi S, Yoshida R, Nishizaki M, Kagawa S, et al. Sarcopenia and comorbidity in gastric cancer surgery as a useful combined factor to predict eventual death from other causes. Ann Surg Oncol 2018;25:1160-6. ArticlePubMedPMCPDF
- 8. Fukuda Y, Yamamoto K, Hirao M, Nishikawa K, Nagatsuma Y, Nakayama T, et al. Sarcopenia is associated with severe postoperative complications in elderly gastric cancer patients undergoing gastrectomy. Gastric Cancer 2016;19:986-93. ArticlePubMedPDF
- 9. Von Elm E, Altman DG, Egger M, Pocock SJ, Gøtzsche PC, Vandenbroucke JP. Iniciativa STROBE. [The strengthening the reporting of observational studies in epidemiology [STROBE] statement:guidelines for reporting observational studies]. Gac Sanit. 2008. 22: p. 144-50. Spanish: ArticlePubMed
- 10. Veterans Affairs Total Parenteral Nutrition Cooperative Study Group. Perioperative total parenteral nutrition in surgical patients. N Engl J Med 1991;325:525-32. ArticlePubMed
- 11. Huh J, Lee IS, Kim KW, Park J, Kim AY, Lee JS, et al. CT gastrography for volumetric measurement of remnant stomach after distal gastrectomy:a feasibility study. Abdom Radiol (NY) 2016;41:1899-905. ArticlePubMedPDF
- 12. Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy-assisted billroth I gastrectomy. Surg Laparosc Endosc 1994;4:146-8. ArticlePubMed
- 13. Hu Y, Kim HI, Hyung WJ, Song KJ, Lee JH, Kim YM, et al. Vitamin B(12) deficiency after gastrectomy for gastric cancer:an analysis of clinical patterns and risk factors. Ann Surg 2013;258:970-5. ArticlePubMed
- 14. Mahmud K, Ripley D, Doscherholmen A. Vitamin B 12 absorption tests. Their unreliability in postgastrectomy states. JAMA 1971;216:1167-71. ArticlePubMed
- 15. Seidell JC, Bakker CJ, van der Kooy K. Imaging techniques for measuring adipose-tissue distribution--a comparison between computed tomography and 1.5-T magnetic resonance. Am J Clin Nutr 1990;51:953-7. ArticlePubMed
- 16. Shuster A, Patlas M, Pinthus JH, Mourtzakis M. The clinical importance of visceral adiposity:a critical review of methods for visceral adipose tissue analysis. Br J Radiol 2012;85:1-10. ArticlePubMedPMC
- 17. Aoyama T, Kawabe T, Hirohito F, Hayashi T, Yamada T, Tsuchida K, et al. Body composition analysis within 1 month after gastrectomy for gastric cancer. Gastric Cancer 2016;19:645-50. ArticlePubMedPDF
- 18. Matsushita H, Tanaka C, Murotani K, Misawa K, Ito S, Ito Y, et al. Nutritional recovery after open and laparoscopic distal gastrectomy for early gastric cancer:a prospective multicenter comparative trial (CCOG1204). Dig Surg 2018;35:11-8. ArticlePubMedPDF
- 19. Park KB, Kwon OK, Yu W, Jang BC. Body composition changes after totally laparoscopic distal gastrectomy with delta-shaped anastomosis:a comparison with conventional billroth I anastomosis. Surg Endosc 2016;30:4286-93. ArticlePubMedPDF
- 20. Liedman B, Andersson H, Bosaeus I, Hugosson I, Lundell L. Changes in body composition after gastrectomy:results of a controlled, prospective clinical trial. World J Surg 1997;21:416-20; discussion 420-1. ArticlePubMedPDF
References
Figure & Data
REFERENCES
Citations

- Optimal proximal resection margin distance for gastrectomy in advanced gastric cancer
Amy Kim, Beom Su Kim, Jeong Hwan Yook, Byung Sik Kim
World Journal of Gastroenterology.2020; 26(18): 2232. CrossRef
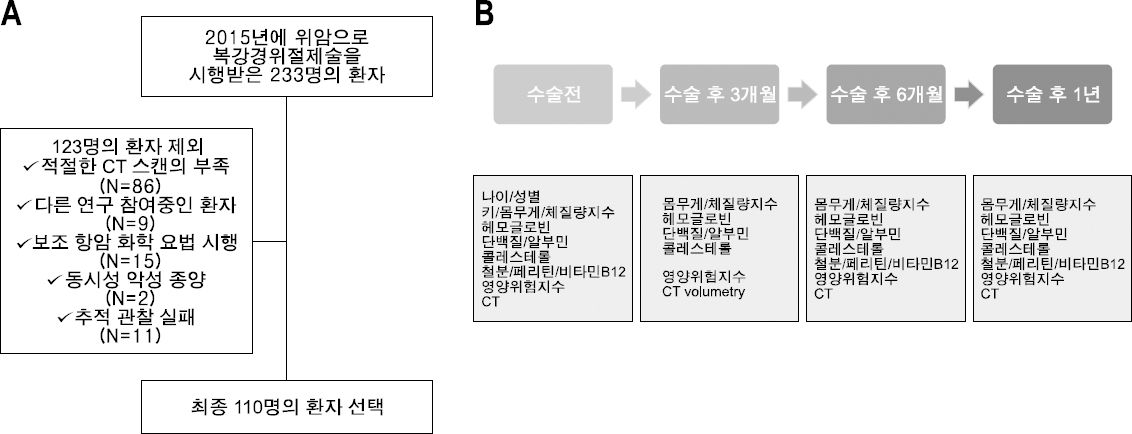
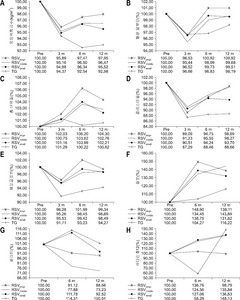
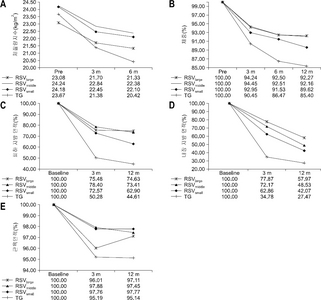
Fig. 1
Fig. 2
Fig. 3
Clinical characteristics of 110 patients
| 특징 | 환자군 | P값 | ||||||
|---|---|---|---|---|---|---|---|---|
| 원위절제술 (N=78) | RSV≤200 cm3 (N=28) | 200<RSV≤500 cm3 (N=39) | RSV>500 cm3 (N=11) | 전절제술 (N=32) | P-value1 | P-value2 | ||
| 나이(년) | 57.45±10.66 | 59.86±11.74 | 55.69±9.15 | 57.55±12.46 | 55.22±10.47 | 0.3214 | 0.4991 | |
| 성별(명) | 남 | 47 (60%) | 17 (60%) | 24 (62%) | 6 (55%) | 18 (56%) | 0.9547 | 0.6979 |
| 여 | 31 (40%) | 11 (40%) | 15 (38%) | 5 (45%) | 14 (44%) | |||
| 키(cm) | 162.63±7.67 | 162.50±7.17 | 162.46±7.67 | 163.60±9.46 | 163.14±7.47 | 0.9595 | 0.4978 | |
| 체중(kg) | 63.81±10.24 | 63.96±9.5 | 64.11±10.11 | 62.36±13.13 | 63.49±13.35 | 0.9722 | 0.3796 | |
| 체질량지수(kg/m2) | 24.05±2.99 | 24.18±2.94 | 24.24±3.06 | 23.08±2.91 | 23.67±3.57 | 0.674 | 0.384 | |
| 잔위용적(cm3) | 290.9±201.4 | 116.8±57.04 | 305.0±72.95 | 684.4±165.9 | <.0001 |
|||
| 문합법(N) | Billroth 1 | 52 | 13 | 29 | 10 | <.0001 | <.0001 | |
| Billroth 2 | 12 | 8 | 4 | 0 | ||||
| RYGJ | 14 | 7 | 6 | 1 | ||||
P-value1은 4개(RSV≤200,200<RSV≤500, RSV>500, 전절제술)그룹 간의 비교.
P-value2는 원위절제술과 전절제술군 간의 비교.
*는 모든 그룹 간의 비교에서 유의했음을 표시함.
RSV = 잔위 용적; RYGJ = Roux-en-Y 위공장문합술.
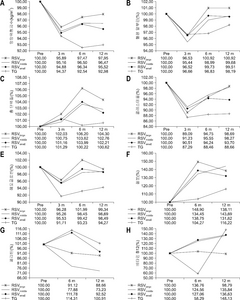
Influence of Remnant Stomach Volume (RSV) on nutrition and anemia
| 단백질/지질관련 관련 | 빈혈 관련 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 인자 | 시간 | 환자군 | P값 | 인자 | 시간 | 환자군 | P값 | ||||||
| RSVlarge | RSVmiddle | RSVsmall | 전절제술 | RSVlarge | RSVmiddle | RSVsmall | 전절제술 | ||||||
| 영양위험 지수 | Pre | 101.4±1.51 | 103.5±0.80 | 100.9±0.94 | 103.0±0.88 | P1<.0001 | 헤모글로빈 (g/dL) | Pre | 13.68±0.45 | 14.25±0.24 | 13.58±0.28 | 13.85±0.26 | P1<.0001 |
| 3 m | 97.31±1.83 | 98.57±0.96 | 95.77±1.13 | 97.23±1.12 | P2 0.0327 | 3 m | 13.17±0.39 | 13.58±0.20 | 12.97±0.24 | 12.70±0.23 | P2 0.0271 | ||
| 6 m | 98.91±1.69 | 99.96±0.93 | 97.24±1.03 | 95.34±1.01 | P3 0.0277 | 6 m | 13.95±0.40 | 14.03±0.21 | 13.50±0.25 | 12.91±0.23 | P3 0.2246 | ||
| 12 m | 99.41±1.83 | 99.93±0.96 | 96.42±1.14 | 95.79±1.05 | 12 m | 13.59±0.42 | 14.07±0.22 | 13.37±0.26 | 13.05±0.24 | ||||
| 혈청 알부민 (g/dL) | Pre | 3.93±0.09 | 4.07±0.05 | 3.9±0.06 | 4.03±0.05 | P1<.0001 | 철분 (mcg/dL) | Pre | 80.83±16.5 | 80.67±12.5 | 83.02±14.4 | 73.62±17.1 | P1 0.0025 |
| 3 m | 3.8±0.09 | 3.88±0.05 | 3.76±0.05 | 3.90±0.05 | P2 0.0882 | 6 m | 120.36±13.3 | 108.46±7.09 | 115.19±8.48 | 76.764±8.34 | P2 0.1021 | ||
| 6 m | 3.97±0.09 | 4.03±0.04 | 3.88±0.05 | 3.90±0.05 | P3 0.6845 | 12 m | 111.64±13.3 | 115.92±7.09 | 109.27±8.59 | 85.560±8.02 | P3 0.6103 | ||
| 12 m | 3.97±0.09 | 4.06±0.04 | 3.88±0.05 | 3.96±0.05 | |||||||||
| 총 단백질 (g/dL) | Pre | 7.18±0.15 | 7.16±0.08 | 7.06±0.09 | 7.19±0.09 | P1 0.0004 | 페리틴 (ng/ml) | Pre | 90.18±24.8 | 144.8±16.2 | 68.43±18.7 | 69.10±21.4 | P1 0.1117 |
| 3 m | 7.32±0.13 | 7.21±0.07 | 7.14±0.08 | 7.28±0.08 | P2 0.3909 | 6 m | 82.17±24.0 | 112.8±12.7 | 76.49±15.1 | 78.99±14.4 | P2 0.0151 | ||
| 6 m | 7.62±0.14 | 7.42±0.07 | 7.34±0.09 | 7.20±0.08 | P3 0.2013 | 12 m | 79.95±20.4 | 106.0±10.8 | 63.31±12.9 | 69.73±12.1 | P3 0.4321 | ||
| 12 m | 7.49±0.14 | 7.35±0.07 | 7.22±0.09 | 7.23±0.08 | |||||||||
| 콜레스테롤 (mg/dL) | Pre | 180.09±11.1 | 190.13±5.92 | 184.18±6.99 | 191.47±6.54 | P1<.0001 | 비타민 B12 (pg/ml) | Pre | 628.61±64.388 | 503.72±50.468 | 452.78±57.444 | 592.72±69.412 | P1 0.697 |
| 3 m | 160.45±9.92 | 173.46±5.29 | 166.71±6.22 | 167.13±5.88 | P2 0.4763 | 6 m | 652.27±70.024 | 627.44±37.188 | 575.3±44.686 | 345.48±44.424 | P2 0.9723 | ||
| 6 m | 170.64±10.3 | 181.67±5.52 | 173.57±6.51 | 169.38±6.09 | P3 0.218 | 12 m | 621±505.3 | 684.23±268.36 | 618.64±328.54 | 878.01±305.91 | P3 0.0053 | ||
| 12 m | 177.73±8.65 | 186.85±4.59 | 172.58±5.45 | 169.75±5.10 | |||||||||
P값의 의미는 4그룹간 P1. time effect, P2. group effect, P3. time–group interaction이다.
RSVsmall group = 잔위용적≤200 cm3; RSVmedium group = 200<잔위용적≤500 cm3; RSVlarge group = 잔위용적>500 cm3.
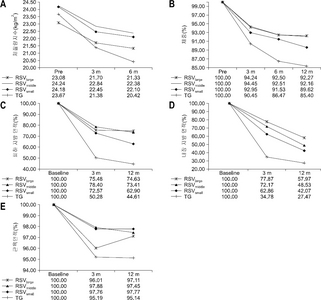
Influence of Remnant Stomach Volume (RSV) on body composition
| 인자 | 시간 | 그룹 | P값 | |||
|---|---|---|---|---|---|---|
| RSVlarge | RSVmiddle | RSVsmall | 전절제술 | |||
| 체질량지수 (kg/m2) | Pre | 23.08±0.95 | 24.23±0.50 | 24.17±0.60 | 23.66±0.56 | P1<.0001 |
| 3 m | 21.70±0.87 | 22.84±0.46 | 22.45±0.54 | 21.37±0.51 | P2 0.1386 | |
| 6 m | 21.33±0.89 | 22.38±0.47 | 22.10±0.55 | 20.41±0.52 | P3 0.007 | |
| 12 m | 21.24±0.85 | 22.30±0.45 | 21.58±0.53 | 20.15±0.50 | ||
| 체중% | 3 m | 94.23±1.50 | 94.44±0.79 | 92.94±0.94 | 90.45±0.92 | P1<.0001 |
| 6 m | 92.50±1.73 | 92.50±0.93 | 91.53±1.07 | 86.47±1.02 | P2 0.0001 | |
| 12 m | 92.27±1.92 | 92.15±1.02 | 89.62±1.21 | 85.39±1.12 | P3 0.0673 | |
| 내장지방면적 (cm2) | Pre | 11649±1233.48 | 11550±1045.15 | 9227.61±1967.95 | 10607±1153.81 | P1<.0001 |
| 3 m (%) | 7085.99±789.37 (62.86±5.28) | 7596.96±668.85 (72.16±4.48) | 6989.07±1259.4 (77.87±8.43) | 3641.08±738.39 (34.78±4.94) | P2 0.1302 P3<.0001 |
|
| 12 m (%) | 4810.04±694.11 (42.06±5.71) | 5215.27±583.18 (48.53±4.76) | 5204.07±1098.1 (57.96±8.98) | 2848.43±646.11 (27.47±5.30) | ||
| 피하지방면적 (cm2) | Pre | 12452±988.31 | 13021±837.42 | 11561±1576.80 | 13277±924.48 | P1<.0001 |
| 3 m (%) | 9401.39±858.13 (72.56±4.02) | 10077±727.11 (78.39±3.40) | 8416±1369.10 (75.47±6.41) | 6971.19±802.70 (50.27±3.76) | P2 0.2985 P3<.0001 |
|
| 12 m (%) | 8295.57±889.94 (62.90±5.31) | 9421.72±748.76 (73.41±4.43) | 8350.52±1409.8 (74.63±8.34) | 6110.13±829.07 (44.60±4.92) | ||
| 근육면적 (cm2) | Pre | 11711±566.5 | 11847±480.01 | 11937±903.82 | 12261±529.91 | P1<.0001 |
| 3 m (%) | 11390±505.29 (97.76±1.37) | 11536±428.14 (97.88±1.16) | 11362±806.16 (96.01±2.19) | 11562±472.65 (95.19±1.28) | P2 0.9842 P3 0.4492 |
|
| 12 m (%) | 11395±507.91 (97.77±1.45) | 11491±429.61 (97.45±1.21) | 11551±808.93 (97.10±2.28) | 11511±474.62 (95.14±1.34) | ||
% 값은 수술 전과 비교 된 매개 변수의 백분율을 나타낸다.
P값의 의미는 4그룹간 P1. time effect, P2. group effect, P3. time–group interaction 이다.
RSVsmall group = 잔위용적≤200 cm3 ; RSVmedium group = 200<잔위용적≤500 cm3 ; RSVlarge group = 잔위용적>500 cm3 .
P-value1은 4개(RSV≤200,200<RSV≤500, RSV>500, 전절제술)그룹 간의 비교. P-value2는 원위절제술과 전절제술군 간의 비교. 는 모든 그룹 간의 비교에서 유의했음을 표시함. RSV = 잔위 용적; RYGJ = Roux-en-Y 위공장문합술.
P값의 의미는 4그룹간 P1. time effect, P2. group effect, P3. time–group interaction이다. RSVsmall group = 잔위용적≤200 cm3; RSVmedium group = 200<잔위용적≤500 cm3; RSVlarge group = 잔위용적>500 cm3.
% 값은 수술 전과 비교 된 매개 변수의 백분율을 나타낸다. P값의 의미는 4그룹간 P1. time effect, P2. group effect, P3. time–group interaction 이다. RSVsmall group = 잔위용적≤200 cm3
; RSVmedium group = 200<잔위용적≤500 cm3
; RSVlarge group = 잔위용적>500 cm3
.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

