Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 11(1); 2020 > Article
- Original Article Analysis of Muscle Using CT Anthropometry in Major Trauma Patients
- Hang Joo Cho, M.D., Ph.D.1, Yunsup Hwang, M.D.2, Yoon Hyun Lee, M.D.1,3, Dae Hyun Cho, M.D.1, Dae-Sang Lee, M.D.1, Maru Kim, M.D., Ph.D.1
- 중증 외상 환자에서 컴퓨터 단층 촬영을 통한 신체계측법을 이용한 근육 분석 연구
- 조항주, M.D., Ph.D.1, 황윤섭, M.D.2, 이윤현, M.D.1,3, 조대현, M.D.1, 이대상, M.D.1, 김마루, M.D., Ph.D.1
-
Surgical Metabolism and Nutrition 2020;11(1):12-15.
DOI: https://doi.org/10.18858/smn.2020.11.1.12
Published online: June 30, 2020
1Department of Trauma Surgery, Uijeongbu St. Mary’s Hospital, College of Medicine, The Catholic University of Korea, Seoul, Korea
2Department of Radiology, Uijeongbu St. Mary’s Hospital, College of Medicine, The Catholic University of Korea, Seoul, Korea
3Armed Forces Medical Commend, Seongnam, Korea
- Correspondence to: Maru Kim, Department of Trauma Surgery, Uijeongbu St. Mary’s Hospital, College of Medicine, The Catholic University of Korea, 271 Cheonbo-ro, Uijeongbu 11765, KoreaTel: +82-31-820-5377, Fax: +82-31-820-5377, E-mail: maru@catholic.ac.kr
The authors wish to acknowledge the financial support the Catholic Medical Center Research Foundation made in the program year of 2018.
This study was presented at 29th Congress of the KSSMN & 2019 International Symposium.
Copyright © 2020 The Korean Society of Surgical Metabolism and Nutrition
This is an open-access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 580 Views
- 1 Download
Abstract
-
Purpose The feasibility of nutritional assessment using computed tomography anthropometry has been previously proven. The abdominal muscle at the L3 vertebra is a well-known nutritional biomarker for predicting the prognosis of various diseases, and especially sarcopenia. However, any studies on nutritional assessment of the brain, face, or neck via computed tomography are still scarce. We retrospectively investigated the applicability of the masseter muscle as a nutritional biomarker.
-
Materials and Methods Patients who underwent simultaneous brain and abdominopelvic computed tomography at a regional trauma center were retrospectively analyzed. Their masseter muscles at 2 cm below the zygomatic arch and abdominal muscle at L3 were assessed via computed tomography anthropometry. Basic clinical data including trauma information was also reviewed. The data was analyzed in conjunction with the patients’ mortality.
-
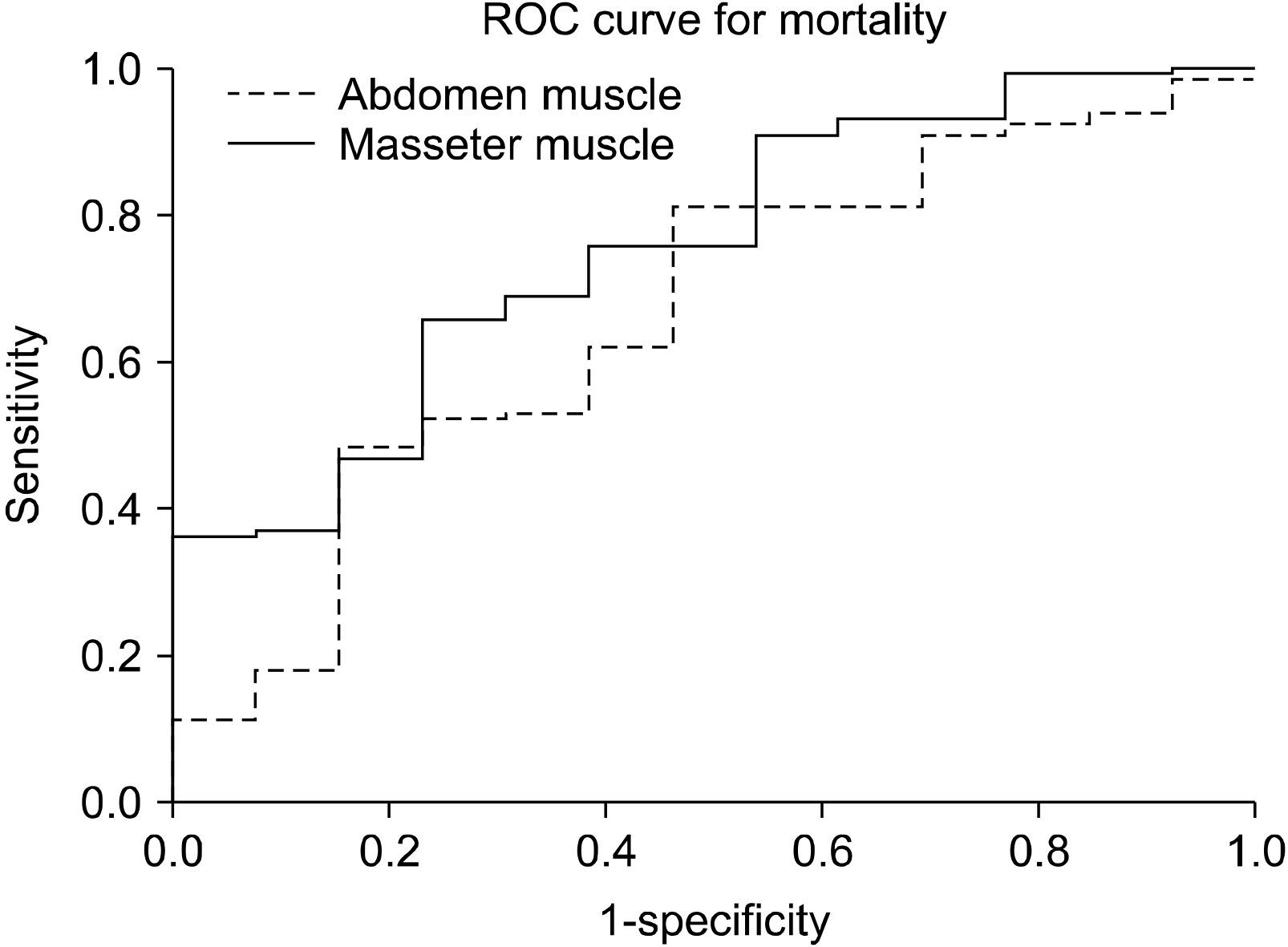
Results A total of 411 patients were analyzed in the study (316 men and 95 women, mean age: 50.41 years, mean areas of the masseter and abdominal muscles: 10.6 and 137.3 cm2, respectively) and there 146 major trauma patients with an injury severity score higher than 15. The masseter muscle area was decreased in the mortality group of major trauma patients (10.4 vs 7.9 cm2, P=0.001). However, abdominal muscles did not show statistical significance (137.9 vs. 117.7 cm2, P=0.054).
-
Conclusion The masseter muscle, when analyzed via computed tomography anthropometry, showed a statistical association with patients’ mortality and it could prove its feasibility as a nutritional biomarker.
서 론
대상 및 방법
결 과
고 찰
FIGURES AND TABLES
| Muscle | Area under curve |
|---|---|
| Abdomen | 0.665 |
| Masseter | 0.756 |
- 1. de Vries MC, Koekkoek WK, Opdam MH, van Blokland D, van Zanten AR. Nutritional assessment of critically ill patients: validation of the modified NUTRIC score. Eur J Clin Nutr 2018;72:428-35. ArticlePubMedPDF
- 2. Cheng YL, Sung SH, Cheng HM, Hsu PF, Guo CY, Yu WC, et al. Prognostic nutritional index and the risk of mortality in patients with acute heart failure. J Am Heart Assoc 2017;6:e004876. ArticlePubMedPMC
- 3. Choi MH, Oh SN, Lee IK, Oh ST, Won DD. 2018;Sarcopenia is negatively associated with long-term outcomes in locally advanced rectal cancer. J Cachexia Sarcopenia Muscle 9:53-9. ArticlePubMedPDF
- 4. Lee JS, Kim YS, Kim EY, Jin W. Prognostic significance of CT-determined sarcopenia in patients with advanced gastric cancer. PLoS One 2018;13:e0202700. ArticlePubMedPMC
- 5. Sengul Aycicek G, Sumer F, Canbaz B, Kara O, Ulger Z. 2015;Sarcopenia evaluated by fat-free mass index in patients with chronic heart failure. Eur J Intern Med 26:e34. ArticlePubMed
- 6. Hanatani S, Izumiya Y, Onoue Y, Tanaka T, Yamamoto M, Ishida T, et al. 2018;Non-invasive testing for sarcopenia predicts future cardiovascular events in patients with chronic kidney disease. Int J Cardiol 268:216-21. ArticlePubMed
- 7. Chargi N, Bril SI, Emmelot-Vonk MH, de Bree R. Sarcopenia is a prognostic factor for overall survival in elderly patients with head-and-neck cancer. Eur Arch Otorhinolaryngol 2019;276:1475-86. ArticlePubMedPMCPDF
- 8. Maeda K, Akagi J. Sarcopenia is an independent risk factor of dysphagia in hospitalized older people. Geriatr Gerontol Int 2016;16:515-21. ArticlePubMed
- 9. Ryan AS, Ivey FM, Serra MC, Hartstein J, Hafer-Macko CE. Sarcopenia and physical function in middle-aged and older stroke survivors. Arch Phys Med Rehabil 2017;98:495-9. ArticlePubMed
- 10. Corcoran NM, Goldman EM. In: Abai B, editor. 2019. Anatomy, head and neck, masseter muscle. StatPearls. StatPearls Publishing; Treasure Island, FL.
- 11. Yamaguchi K, Tohara H, Hara K, Nakane A, Yoshimi K, Nakagawa K, et al. Factors associated with masseter muscle quality assessed from ultrasonography in community-dwelling elderly individuals: a cross-sectional study. Arch Gerontol Geriatr 2019;82:128-32. ArticlePubMed
- 12. Gaszynska E, Godala M, Szatko F, Gaszynski T. Masseter muscle tension, chewing ability, and selected parameters of physical fitness in elderly care home residents in Lodz, Poland. Clin Interv Aging 2014;9:1197-203. PubMedPMC
- 13. Mccusker A, Khan M, Kulvatunyou N, Zeeshan M, Sakran JV, Hayek H, et al. Sarcopenia defined by a computed tomography estimate of the psoas muscle area does not predict frailty in geriatric trauma patients. Am J Surg 2019;218:261-5. ArticlePubMed
- 14. Wallace JD, Calvo RY, Lewis PR, Brill JB, Shackford SR, Sise MJ, et al. Sarcopenia as a predictor of mortality in elderly blunt trauma patients: comparing the masseter to the psoas using computed tomography. J Trauma Acute Care Surg 2017;82:65-72. PubMed
References
Figure & Data
REFERENCES
Citations

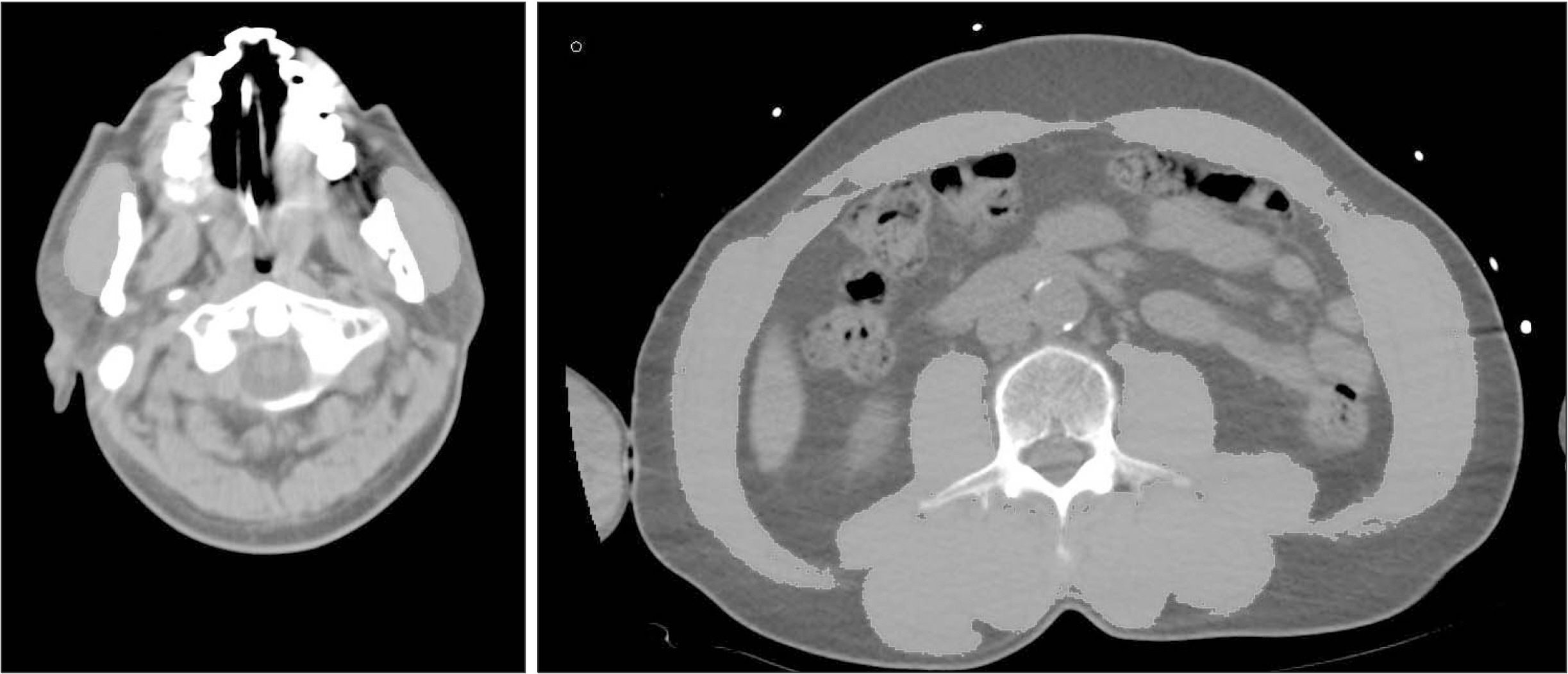
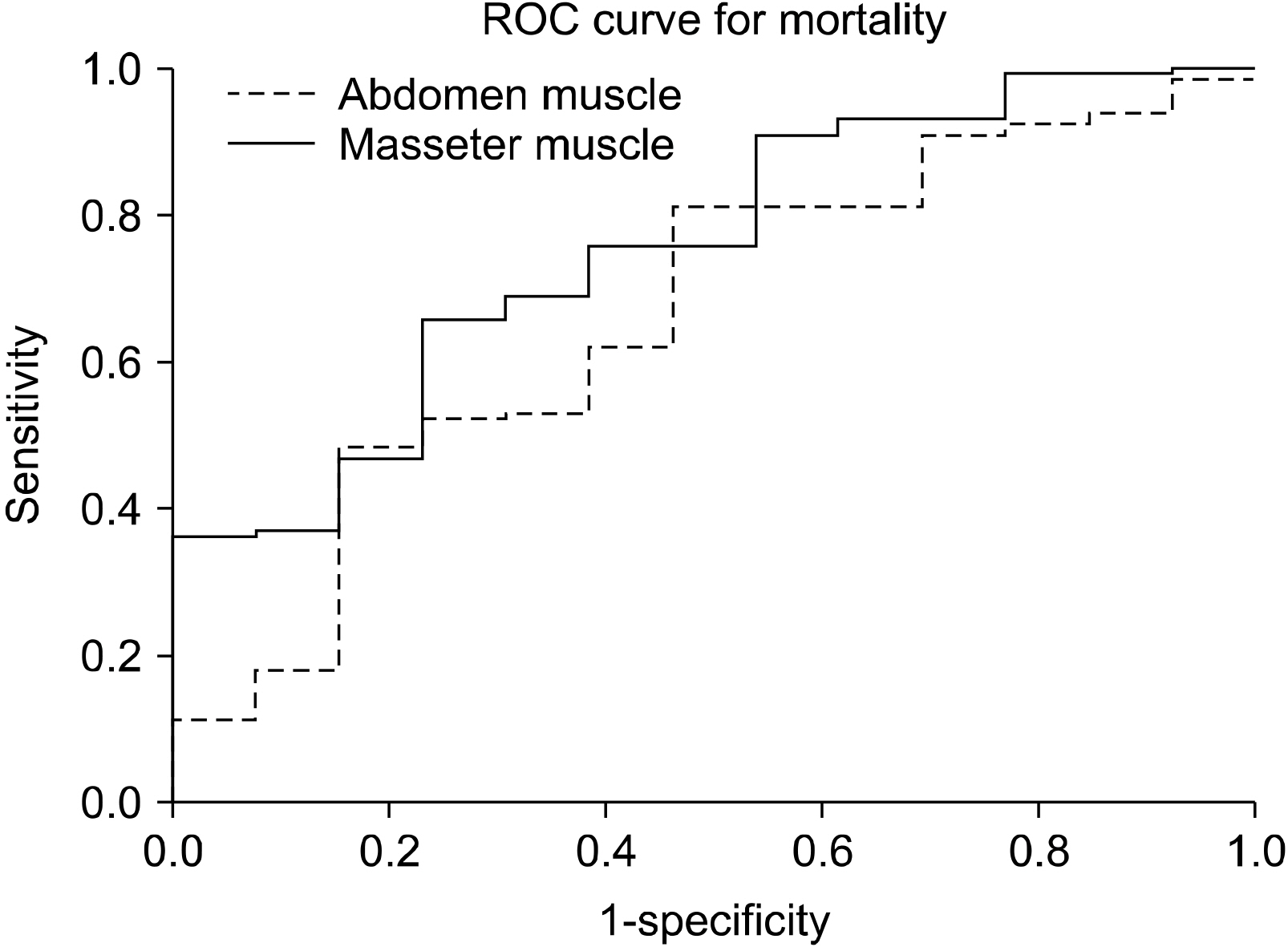
Fig. 1
Fig. 2
Baseline characteristics of enrolled patients
| Parameters | ||
|---|---|---|
| Gender | Male | 316 (76.9) |
| Female | 95 (23.1) | |
| Age | 50.41±18.14 | |
| Height (cm) | 168.31±8.21 | |
| Weight (kg) | 67.46±12.74 | |
| BMI (kg/m2) | 23.73±3.58 | |
| Muscle area (cm2) | Masseter | 10.56±2.81 |
| Abdomen | 137.26±36.19 | |
| Major trauma patient | No | 265 (24.5) |
| Yes | 146 (35.5) | |
Qualitative variables are presented as number (percent%). Quantitative variables are presented as mean±standard deviation.
Risk factors for mortality of major trauma patients
| Variables | Survival | Mortality | P-value | |
|---|---|---|---|---|
| Gender | Male | 105 (92.9) | 8 (7.1) | 0.170 |
| Female | 28 (84.8) | 5 (15.2) | ||
| Age (years) | 53.56±17.52 | 61.85±18.41 | 0.107 | |
| Height (cm) | 168.83±7.74 | 164.85±12.65 | 0.285 | |
| Weight (kg) | 67.87±12.94 | 62.46±15.54 | 0.160 | |
| BMI (kg/m2) | 23.77±3.90 | 22.64±2.97 | 0.310 | |
| Injury severity score | 23.10±6.45 | 27.08±9.23 | 0.154 | |
| Muscle area (cm2) | Masseter | 10.36±2.62 | 7.86±2.26 | 0.001 |
| Abdomen | 137.90±36.00 | 117.71±33.42 | 0.054 | |
Qualitative variables are presented as number (percent%). Quantitative variables are presented as mean±standard deviation.
Area under curve of receiver operating curve analysis
| Muscle | Area under curve |
|---|---|
| Abdomen | 0.665 |
| Masseter | 0.756 |
Qualitative variables are presented as number (percent%). Quantitative variables are presented as mean±standard deviation.
Qualitative variables are presented as number (percent%). Quantitative variables are presented as mean±standard deviation.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN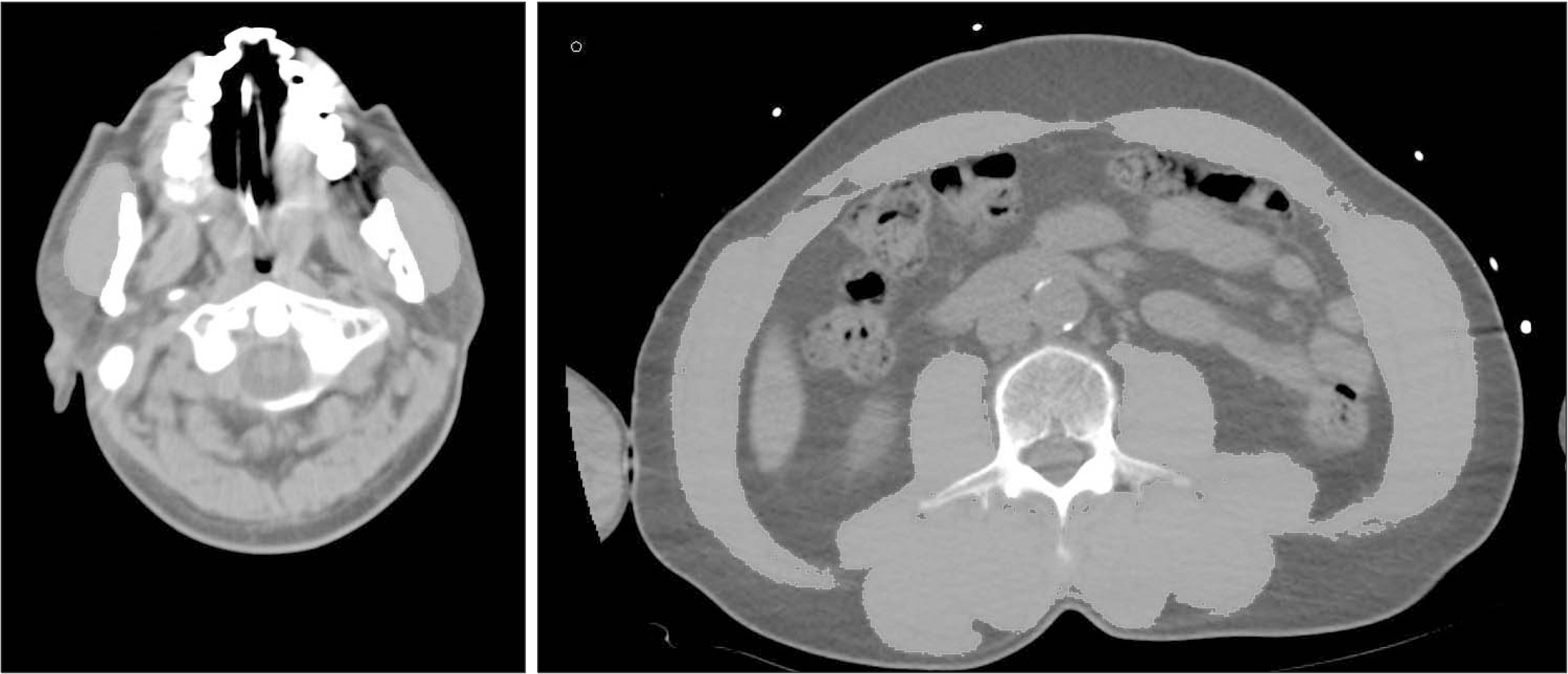
 Cite
Cite

