Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > J Clin Nutr > Volume 7(3); 2015 > Article
- Original Article Evaluation of Postoperative Nutrition Support with Commercial Peripheral Parenteral Nutrition after an Ivor-Lewis Esophagectomy in Patients with Esophageal Cancer
- Sun-woo Lee1, Na-ri Lim1, Hyo Jung Park1, Yong-won In1, Jeong-meen Seo2, Young-mee Lee1
- Ivor-Lewis 식도절제술 후 상품형 말초정맥용 영양수액 사용 평가
- 이선우1, 임나리1, 박효정1, 인용원1, 서정민2, 이영미1
-
Journal of the Korean Society for Parenteral and Enteral Nutrition 2015;7(3):87-92.
DOI: https://doi.org/10.15747/jcn.2015.7.3.87
Published online: December 31, 2015
Department of Pharmaceutical Services, Samsung Medical Center, Seoul, Korea
Department of Surgery, Samsung Medical Center, Seoul, Korea
- Correspondence to Hyo Jung Park Department of Pharmaceutical Services, Samsung Medical Center, 81 Irwon-ro, Gangnam-gu, Seoul 06351, Korea Tel: +82-2-3410-6091, Fax: +82-2-3410-6094, E-mail: hyoj.park@samsung.com
Copyright: © Korean Society for Parenteral and Enteral Nutrition
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 768 Views
- 1 Download
Abstract
-
Purpose: Deteriorated nutritional status is common during a hospital stay for esophagectomy in patients with esophageal cancer. Malnutrition in those patients is often marked compared with other gastrointestinal cancer. The purpose of this study is to evaluate the appropriateness of commercial peripheral parenteral nutrition (CPPN) use in patients who underwent Ivor-Lewis esophagectomy (I-L op).
-
Methods: Patients who were provided with CPPN after I-L op were enrolled in this study from January to May 2015. Body weight, height, nutritional status, length of hospital stay, duration of CPPN therapy, and parenteral nutrition (PN) induced complications were assessed, respectively, using electronic medical records.
-
Results: Thirty-nine patients were enrolled. Average age was 65.9 years and 36 patients were male. All patients were provided with the same CPPN. The duration of fasting and CPPN use was 5.8±1.4 days and 7.5±1.8 days, respectively. Calorie supported by CPPN was 22.6±3.5 kcal/kg/day and only 20.5% of patients (n=8) reached the daily target calories. Most frequent PN induced complication was phlebitis which occurred in 8 patients (20.5%). Calcium, magnesium, and transthyretin levels in serum were not monitored during the PN support period.
-
Conclusion: The indications for CPPN were appropriate because the fasting duration in patients with I-L op was 5 to 10 days. Although a large portion of patients could not be supplied daily target calories, their nutrition status was not significantly changed on admission and at discharge. We did not find it necessary to individualize PN support for a short period after an I-L op in patients with esophageal cancer. Further study will be needed to determine why the incidence of phlebitis was dominant.
서론
대상 및 방법
결과
| Characteristic | Value |
|---|---|
| Number of patients | 39 |
| Sex (male:female) | 12:1 |
| Age (y) | 65.9±9.2 |
| Body weight (kg)a | 64.7±8.1 |
| Height (cm) | 166.4±9.8 |
| History of smoking | 34 (87.2) |
| Duration of smoking (y) | 29.4±13.2 |
| Histologic type | |
| Squamous cell carcinoma | 36 (92.3) |
| Adenocarcinoma | 2 (5.1) |
| Malignant melanoma | 1 (2.6) |
| Nutritional status | On admission | At discharge |
|---|---|---|
| Normal | 36 (92.3) | 36 (92.3) |
| Mild malnutrition | 2 (5.1) | 0 (0) |
| Moderate malnutrition | 0 (0) | 2 (5.1) |
| Obesity | 1 (2.6) | 1 (2.6) |
고찰
결론
- 1. Novak F, Heyland DK, Avenell A, Drover JW, Su X. Glutamine supplementation in serious illness: a systematic review of the evidence. Crit Care Med 2002;30(9):2022-9. ArticlePubMed
- 2. Mayer RJ. Harrison’s principles of internal medicine. 18th ed. New York: McGraw-Hill; 2012.Article
- 3. Heyland D, Wischmeyer PE, Day AG. Canadian Clinical Care Trials Group. Glutamine and antioxidants in critically ill patients. N Engl J Med 2013;369(5):484-5. Article
- 4. Barreto JC, Posner MC. Transhiatal versus transthoracic esophagectomy for esophageal cancer. World J Gastroenterol 2010;16(30):3804-10. ArticlePubMedPMC
- 5. Reed CE. Technique of open ivor lewis esophagectomy. Oper Tech Thorac Cardiovasc Surg 2009;14(3):160-75. Article
- 6. Saito T, Zeze K, Kuwahara A, Miyahara M, Kobayashi M. Correlations between preoperative malnutrition and septic complications of esophageal cancer surgery. Nutrition 1990;6(4):303-8. ArticlePubMed
- 7. Ward N. Nutrition support to patients undergoing gastrointestinal surgery. Nutr J 2003;2:18.ArticlePubMedPMCPDF
- 8. Lee H, Kang JH, Kim E, Kim WG. Prevalence of malnutrition in hospitalized elderly Korean patients based on mini nutritional assessment-short form. J Clin Nutr 2014;6(1):24-9. Article
- 9. Willard MD, Gilsdorf RB, Price RA. Protein-calorie malnutrition in a community hospital. JAMA 1980;243(17):1720-2. ArticlePubMed
- 10. Stephen LB, Marjorie S, Andrew CB, Paul AK. American Society for Parenteral and Enteral Nutrition. The A.S.P.E.N. nutrition support practice manual. 1st ed. Silver Spring: American Society for Parenteral and Enteral Nutrition; 2005. p. 259-62. Article
- 11. Duguet A, Bachmann P, Lallemand Y, Blanc-Vincent MP. FNCLCC. Summary report of the Standards, Options and Recommendations for malnutrition and nutritional assessment in patients with cancer (1999). Br J Cancer 2003;89(Suppl 1):S92-7. ArticlePubMedPMCPDF
- 12. Wu MH, Lin MT, Chen WJ. Effect of perioperative parenteral nutritional support for gastric cancer patients undergoing gastrectomy. Hepatogastroenterology 2008;55(82-83):799-802. ArticlePubMed
- 13. Argilés JM. Cancer-associated malnutrition. Eur J Oncol Nurs 2005;9(Suppl 2):S39-50. ArticlePubMed
- 14. Seike J, Tangoku A, Yuasa Y, Okitsu H, Kawakami Y, Sumitomo M. The effect of nutritional support on the immune function in the acute postoperative period after esophageal cancer surgery: total parenteral nutrition versus enteral nutrition. J Med Invest 2011;58(1-2):75-80. ArticlePubMed
- 15. Bozzetti F, Braga M, Gianotti L, Gavazzi C, Mariani L. Postoperative enteral versus parenteral nutrition in malnourished patients with gastrointestinal cancer: a randomised multicentre trial. Lancet 2001;358(9292):1487-92. ArticlePubMed
- 16. Shrikhande SV, Shetty GS, Singh K, Ingle S. Is early feeding after major gastrointestinal surgery a fashion or an advance? Evidence-based review of literature. J Cancer Res Ther 2009;5(4):232-9. ArticlePubMed
- 17. Braga M, Ljungqvist O, Soeters P, Fearon K, Weimann A, Bozzetti F. ESPEN. ESPEN Guidelines on Parenteral Nutrition: surgery. Clin Nutr 2009;28(4):378-86. ArticlePubMed
- 18. Bozzetti F. Nutritional support of the oncology patient. Crit Rev Oncol Hematol 2013;87(2):172-200. ArticlePubMed
- 19. Muscaritoli M, Molfino A, Laviano A, Rasio D, Rossi Fanelli F. Parenteral nutrition in advanced cancer patients. Crit Rev Oncol Hematol 2012;84(1):26-36. ArticlePubMed
- 20. Fearon K, Strasser F, Anker SD, Bosaeus I, Bruera E, Fainsinger RL, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011;12:489-95. ArticlePubMed
- 21. Riskin A, Shiff Y, Shamir R. Parenteral nutrition in neonatology--to standardize or individualize? Isr Med Assoc J 2006;8(9):641-5. ArticlePubMed
- 22. Beecroft C, Martin H, Puntis JW. How often do parenteral nutrition prescriptions for the newborn need to be individualized? Clin Nutr 1999;18(2):83-5. ArticlePubMed
- 23. Lee MS. Nutritional management in gastric cancer patients. J Korean Gastric Cancer Assoc 2003;3(4):172-7.ArticlePDF
References
Figure & Data
REFERENCES
Citations

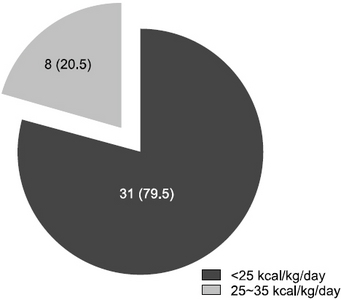
Fig. 1
Baseline demographics of patients
| Characteristic | Value |
|---|---|
| Number of patients | 39 |
| Sex (male:female) | 12:1 |
| Age (y) | 65.9±9.2 |
| Body weight (kg) |
64.7±8.1 |
| Height (cm) | 166.4±9.8 |
| History of smoking | 34 (87.2) |
| Duration of smoking (y) | 29.4±13.2 |
| Histologic type | |
| Squamous cell carcinoma | 36 (92.3) |
| Adenocarcinoma | 2 (5.1) |
| Malignant melanoma | 1 (2.6) |
Values are presented as number only, mean±standard deviation, or number (%).
aOn admission.
Nutritional management after Ivor-Lewis esophagectomy
| Nutritional management | Value |
|---|---|
| Duration of fasting (d) | 5.8±1.4 |
| Length of hospital stay (d) | 13.4±3.4 |
| EN during CPPN | 2 (5.1) |
| Volume of CPPN (mL/day) | 2,020 |
| Calorie of CPPN (kcal/day) | 1,396 |
| Duration of CPPN (d) | 7.5±1.8 |
| Macro-nutrients provided by CPPN | |
| Dextrose (g/kg/day) | 2.3±0.4 |
| Amino acid (g/kg/day) | 1.0±0.2 |
| Lipid (g/kg/day) | 0.9±0.1 |
Values are presented as mean±standard deviation or number (%).
EN = enteral nutrition; CPPN = commercial peripheral parenteral nutrition.
Comparison of nutritional status on admission and at discharge
| Nutritional status | On admission | At discharge |
|---|---|---|
| Normal | 36 (92.3) | 36 (92.3) |
| Mild malnutrition | 2 (5.1) | 0 (0) |
| Moderate malnutrition | 0 (0) | 2 (5.1) |
| Obesity | 1 (2.6) | 1 (2.6) |
Values are presented as number (%).
Values are presented as number only, mean±standard deviation, or number (%). On admission.
Values are presented as mean±standard deviation or number (%). EN = enteral nutrition; CPPN = commercial peripheral parenteral nutrition.
Values are presented as number (%).

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN
 Cite
Cite

