Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 6(1); 2015 > Article
- REVIEW ARTICLE Role of Retinol Binding Protein as a Biochemical Markers for Nutritional Status Assessment
- Se Youl Lee, M.D1,2, Sang In Bae, M.D1,2, Hee Chul Yu, M.D., Ph.D1,2,3
- 영양상태평가를 위한 생화학지표로서 레티놀 결합 단백질의 역할
- 이세열, M.D1,2, 배상인, M.D1,2, 유희철, M.D., Ph.D1,2,3
-
Surgical Metabolism and Nutrition 2015;6(1):7-10.
DOI: https://doi.org/10.18858/smn.2015.6.1.7
Published online: June 30, 2015
Department of Surgery, Chonbuk National University Medical School
Nutritional Support Team, Chonbuk National University Hospital
Research institute of Clinical Medicine of Chonbuk National University-Biomedical Research Institute of Chonbuk National University Hospital, Jeonju, Korea
- Correspondence to: Hee Chul Yu, Department of Surgery, Chonbuk National University Medical School, 20 Geonji-ro, Deokjin-gu, Jeonju 561-180, Korea Tel: +82-63-250-1576, Fax: +82-63-271-6197 E-mail: hcyu@jbnu.ac.kr
Copyrights © The Korean Society of Surgical Metabolism and Nutrition
This is an Open Access article distribute under the terms of the Creative Commons Attribution Non-commercial License (http://creativecommons.org/license/by-nc/3.0.) which permits unrestricted non-commercial use, distribution,and reproduction in any medium, provided the original work is properly cited.
- 1,913 Views
- 7 Download
- 3 Crossref
Abstract
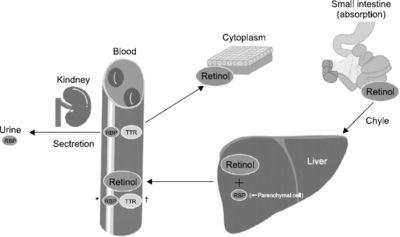
- Malnutrition has a significant impact on the recovery of patients. Assessment of nutritional status and appropriateness of nutritional support is of clinical importance. In the various nutritional assessment methods, biochemical markers (albumin, pre-albumin, retinol binding protein, and transferrin) are widely used for high sensitivity and objectivity. For application of the biochemical markers, it should be understood that the markers have merits and de-merits. Author investigates the retinol binding protein, one of the most sensitive biochemical markers, in more detail. Retinol binding protein (RBP) is synthesized in liver (mainly, parenchymal cells) and catalyzed in kidney. RBP transports retinol, alcohol form of vitamin A, from liver to tissue. Also, RBP and transthyretin (TTR, formerly called pre-albumin) form a macromolecular complex to prevent glomerular filtration of the low molecular weight RBP in the kidney. RBP is a very useful biochemical marker because it has short half-life and immediate response to deficiency or in support of calorie and protein. However, because serum RBP level is greatly affected by the liver and kidney function, understanding of the underlying disease of patients is necessary. Moreover, it is not widely used due to very short half-life and non-generalized measurement methods. Consequently, understanding the characteristics of RBP is necessary and effort should be made to properly utilize the RBP in nutrition support and assessment.
서론
Modified from Mears. [1]
본론
결론
- 1. Mears E. Nutritional assessment: The key to positive outcomes and financial impact. Lab Med 2007;38:43-7. Article
- 2. Butterworth CE Jr. The skeleton in the hospital closet. Nutr Today 1974;9:4-8. Article
- 3. Banh L. Serum proteins as markers of nutrition: what are we treating? Pract Gastroenterol 2006;30:46-64.
- 4. Fuhrman MP, Charney P, Mueller CM. Hepatic proteins and nutrition assessment. J Am Diet Assoc 2004;104:1258-64. ArticlePubMed
- 5. Kanai M, Raz A, Goodman DS. Retinol-binding protein: the transport protein for vitamin A in human plasma. J Clin Invest 1968;47:2025-44. ArticlePubMedPMC
- 6. de Pee S, Dary O. Biochemical indicators of vitamin A deficiency: serum retinol and serum retinol binding protein. J Nutr 2002;132(9 Suppl):2895S-901S. ArticlePubMed
- 7. Monaco HL. The transthyretin-retinol-binding protein complex. Biochim Biophys Acta 2000;1482:65-72. ArticlePubMed
- 8. Smeland S, Bjerknes T, Malaba L, Eskild W, Norum KR, Blomhoff R. Tissue distribution of the receptor for plasma retinol-binding protein. Biochem J 1995;305:419-24. ArticlePubMedPMCPDF
- 9. Newcomer ME, Ong QDE. Plasma retinol binding protein: structure and function of the prototypic lipocalin. Biochim Biophys Acta 2000;1482:57-64. ArticlePubMed
- 10. Jo MW, Shin DS. Effect of dietary fibers on retinol binding protein (RBP, cRBP I, cRBPII) gene expression in rats fed high fat diet. Korean J Nutr 2005;38:817-26.
- 11. Montedonico S, Nakazawa N, Puri P. Congenital diaphragmatic hernia and retinoids: searching for an etiology. Pediatr Surg Int 2008;24:755-61. ArticlePubMedPMC
- 12. Kanamori K, Shiba K, Sawada K, Kurihara Y, Mashige F, Sakatsume M, et al. Evaluation of the measurement of urinary retinol-binding protein by “N-Assay LA RBP Nittobo” for serum retinol-binding protein reagent. JJCLA 2008;33:876-81.
- 13. Shima H, Okano H, Tadokoro S, Hirose K, Tomuro Y, Huruki S, et al. Evaluation of the assays of serum transferrin, retinol binding protein, and prealbumin by Behring Nephelometer Analyzer (BNA). Jpn J Med Pharm Sci 1994;32:145-53.
- 14. Winkler MF, Gerrior SA, Pomp A, Albina JE. Use of retinol-binding protein and prealbumin as indicators of the response to nutrition therapy. J Am Diet Assoc 1989;89:684-7. ArticlePubMed
- 15. Helms RA, Dickerson RN, Ebbert ML, Christensen ML, Herrod HG. Retinol-binding protein and prealbumin: useful measures of protein repletion in critically ill, malnourished infants. J Pediatr Gastroenterol Nutr 1986;5:586-92. ArticlePubMed
- 16. Ihara H, Matsumoto T, Shino Y, Hashizume N, Takase M, Nagao J, et al. Selective use of transthyretin and retinol-binding protein as markers in the postoperative assessment of protein nutritional status. J Clin Lab Anal 2003;17:1-5. ArticlePubMedPMC
- 17. Bae SI, Yu HC, Jung MJ, Yang JD, Kim DS, Lee MR, et al. Assessment of serum retinol binding protein as a marker of nutritional status after pancreaticoduodenectomy. Surg Metab Nutr 2013;4:25-30.
- 18. Yang Q, Graham TE, Mody N, Preitner F, Peroni OD, Zabolotny JM, et al. Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes. Nature 2005;436:356-62. ArticlePubMedPDF
- 19. Goodman DS. Plasma retinol-binding protein. Ann N Y Acad Sci 1980;348:378-90. ArticlePubMed
- 20. Chaves GV, Ferreira Peres WA, Gonçalves JC, Ramalho A. Vitamin A and retinol-binding protein deficiency among chronic liver disease patients. Nutrition [In press].Article
- 21. Cano N, Di Costanzo-Dufetel J, Calaf R, Durbec JP, Lacombe P, Pascal S, et al. Prealbumin-retinol-binding-protein-retinol complex in hemodialysis patients. Am J Clin Nutr 2014;1988;47:664-7. ArticlePubMed
- 22. Pallet N, Chauvet S, Chassé JF, Vincent M, Avillach P, Levi C, et al. Urinary retinol binding protein is a marker of the extent of interstitial kidney fibrosis. PLoS One 2014;9:e84708.ArticlePubMedPMC
References
Figure & Data
REFERENCES
Citations

- Serum biomarkers for nutritional status as predictors in COVID-19 patients before and after vaccination
Rita Vaz-Rodrigues, Lorena Mazuecos, Margarita Villar, José Miguel Urra, Christian Gortázar, José de la Fuente
Journal of Functional Foods.2023; 101: 105412. CrossRef - Nutritional status evaluation in critical care: A study of clinical practices
Achwak Mehrez, Om Kalthoum Sallem, Hela Attia, Karim Masmoudi, Kais Gardabou, Ali Majdoub
Nutrition Clinique et Métabolisme.2023; 37(1): 51. CrossRef - Application of an early oral feeding protocol after pylorus-preserving pancreaticoduodenectomy
Jungmin Cho, Hyung Mi Kim, Mina Song, Joon Seong Park, Seung-Min Lee
Supportive Care in Cancer.2019; 27(3): 981. CrossRef
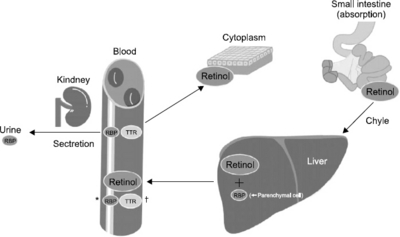
Fig. 1
Biochemical markers for nutritional status
| Protein | Half-Life | Advantages | Disadvantages | Reference Range | Medical Decision Point |
|---|---|---|---|---|---|
| Albumin | 21 days | - Easy and inexpensive to measure - Reimbursement easy |
- Long half-life (21 days) - Affected by dehydration/overhydration - Often given as part of therapy - Affected by liver and kidney disease |
3.6~5.5 g/dl | 3.0 g/dl |
| Transferrin | 8 days | - Shorter half-life - Levels decreased in severe malnutrition |
- Affected by iron deficiency - Sensitive to hormones and antibiotics - Greatly decreased in patients with liver disease - Affected by infection/inflammation |
200~400 mg/dl | 150 mg/dl |
| Retinol binding protein | 12 hours | - Very short half-life - Parallels well with prealbumin - Excellent sensitivity to nutritional status |
- Greatly affected by kidney disease - Decreased in liver cirrhosis/vitamin A deficiency/hyperthyroidism - Affected by infection/inflammation |
3.0~6.0 mg/dl | 1.6 mg/dl |
| Pre-albumin | 2 days | - Short half-life - Excellent sensitivity to nutritional status - High in tryptophan - Good for risk stratification/classification |
- Decreased in end stage liver disease - Affected by infection/inflammation |
17~34 mg/dl | 11 mg/dl |
Modified from Mears. [1]
Modified from Mears. [

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

