Indexed in:
Scopus, KCI, KoreaMed
Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 7(1); 2016 > Article
- REVIEW ARTICLE Immunonutrition and Amino Acids
- Dong Woo Shin, M.D.
- 면역영양과 아미노산
- 신동우, M.D.
-
Surgical Metabolism and Nutrition 2016;7(1):13-19.
DOI: https://doi.org/10.18858/smn.2016.7.1.13
Published online: June 30, 2016
Department of Surgery, Dongtan Sacred Heart Hospital, Hallym University College of Medicine, Hwaseong, Korea
- Correspondence to: Dong Woo Shin, Department of Surgery, Dongtan Sacred Heart Hospital, Hallym University College of Medicine, 7 Keunjaebong-gil, Hwaseong 18450, Korea Tel: +82-31-8086-2430, Fax: +82-31-8086-2029, E-mail: shin519@hallym.or.kr
• Received: June 6, 2016 • Accepted: June 18, 2016
Copyright: © The Korean Society of Surgical Metabolism and Nutrition
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 995 Views
- 8 Download
Abstract
- Loss of body protein—mostly from skeletal muscles—is the most characteristic sign of critical illness. The most common immune-enhancing nutrients for favorable Compensatory Anti-inflammatory Response Syndrome (CARS) are glutamine, arginine, poly-unsaturated fatty acid, some trace elements and probiotics. Glutamine is an essential amino acid with an important role it fuels the proliferation of cells and acts as a precursor to antioxidant glutathione. The conflicting results of glutamine trials are largely related to its dosage and duration of treatment. However, its overall effects, when parenterally or enterally supplied, are thought to be helpful in immune-enhancing and decreasing infectious complications. Arginine is also conditionally essential and has an important role in the synthesis of anabolic hormones and in the activation of T lymphocytes. It also is converted to citrulline and nitric oxide, the latter is a potent intracellular signaling molecule. Leucine and citrulline are common in the mechanism of action and are mediated by the mTOR signaling pathway. Both leucine- and citrulline-enriched diets have been proven to increase nutritional status in various experimental models of injury. However, there are conflicting data about when they were supplied to the critically ill patients. The role of the most immune-modulating nutrients have not been fully discovered thus far. For critically ill patients, basic support with macro-nutrients should come first, followed by other specially provided nutrients, such as immunonutrients.
서론
영양상태 평가 및 영양의 관리는 환자 치료 과정에 있어서 매우 중요한 부분으로 자리매김되고 있으며 각종 임상 질평가에서 주요 지표로 사용되기 시작하였다. 특히 중환자 치료에 있어서 영양치료는 환자의 예후를 결정하는 결정적 역할을 담당한다고 할 수 있다. 중환자의 영양실조는 면역기능의 장애와 각종 장기의 약화로 인한 장기 부전을 결과로 이어져, 감염 합병증과 사망의 확률을 급증시키기 때문이다.[1]
더군다나 지난 20여년간 우리나라는 급격한 인구의 고령화 과정을 겪고 있으며 그로 인해 중환자의 특징도 많은 변화를 보이고 있어서 연령은 더욱 높아졌고, 한 두가지 이상의 만성질환을 가지고 있는 환자가 많으며, 만성 질환으로 인한 영양실조의 상태에서 중증 질환을 겪게된 환자가 많아졌다고 할 수 있다. 하지만 의학지식의 발달, 환자관리 체계의 전산화 등으로 중환자 치료의 성과는 날로 호전되고 있다고 할 수 있으며, 이 가운데 영양실조와 면역결핍의 연관성이 뚜렷이 밝혀지면서 면역영양에 대한 관심이 증대하고 있다.
면역영양의 정의는 처음에는 면역계의 세포 활동에 영향을 주는 영양소들을 공급하는 것을 면역영양이라고 하였지만, 손상이나 스트레스에 대한 반응기전이 좀 더 밝혀지고 각각의 기전에 대처할 수 있는 방법들이 연구되면서 단순히 환자의 면역 기능을 향상시킬 뿐 아니라 염증반응을 조절하고 장의 장벽기능을 향상시켜 세균의 성장을 억제하는 것을 목표로 하는 인공 영양을 면역영양이라 정의하게 되었다.
본 논문은 면역영양소로 소개되어 있는 여러 영양소 가운데 아미노산 제제의 종류와 그 역할에 대해 고찰하여 보고자 작성하였다.
본론
1970년대에 Stanley J. Dudrick경의 중심정맥을 이용한 정맥영양의 시대가 도래한 뒤 인체에 질병, 외상, 스트레스가 가해졌을 때 진행되는 내분비, 대사 및 면역계의 반응이나 변화에 대해 많은 연구가 진행되었고, 이를 극복하기 위한 방법으로서 적절한 영양공급 및 면역강화의 치료법은 이제 교과서적인 기본틀로 자리잡고 있다. 그럼에도 불구하고 아직 정확히 밝혀지지 않은 영양소의 작용이나 역할, 사용시 얻을 수 있는 득과 실의 정보가 너무나 부족한 경우가 많다.
1980년대 초, Cerra [2]는 외상이나 스트레스로 다발성 장기부전이 발생한 환자가 더 이상 외상이나 스트레스를 받고 있지 않아도 대사반응은 지속적으로 활성화되어 심지어 체내 단백의 고갈에 이른다는 보고를 하였다. 결국 과도한 신진대사(Hypermetabolism)가 체내 단백을 고갈시키기 때문에 단백에너지 영양결핍(Protein-energy malnutrition)이 발생하게 되며 이러한 단백에너지 영양결핍은 세포면역 기능에 손상을 야기하여 환자의 나쁜 예후 원인으로 작용할 수 있다. 하지만 이렇게 발생한 단백에너지 영양결핍은 정맥 혹은 경장영양으로 쉽게 교정이 될 수 있고 빠르게 세포면역의 기능이 회복될 수 있다. 또한 중증 화상을 입은 아동환자를 대상으로 일반적 열량공급과 단백질 함량을 높인 영양공급을 비교한 전향적 무작위 대조군 연구에서 고단백질의 공급이 영양지표를 개선하고 감염의 합병증을 낮춘다고 하였다.[3]
Fig. 1은 염증성 반응에 따른 다발성 장기부전의 과정을 위장관의 역할과 함께 나타낸 것이다. 저혈압에 의한 위장관 허혈은 염증반응의 가속화 요인으로 작용할 뿐 아니라 염증반응 후에 나타나는 보상성 항염증반응증후군(Compensatory Anti-inflammatory Response Syndrome; CARS)의 희생양이 되어 다발성 장기부전의 악순환 고리를 만들 수 있다.[4] 이러한 과정에서 이미 일반적으로 그 이로움이 밝혀진 조기 경장영양의 효과가 설명될 수 있다. 패혈증, 출혈성 쇼크, 위장관의 허혈 및 재관류 손상 모델 등 여러 다발성 장기부전 모델에서 장내 영양소가 투여되면 쇼크로 인한 점막관류감소을 막아주고 세균전위를 감소시키며 장의 투과성을 낮춰 궁극적으로 조기 경장영양은 보상성 항염증반응증후군이 좀 더 약하게 나타나도록 하고 과대사로 인한 악순환을 막아주는 역할을 할 수 있다.
이러한 방식으로 면역반응의 발현과 그 정도를 조절함으로써 환자의 예후를 호전시킬 수 있는 영양치료를 면역영양법이라고 할 수 있다. 조기 경장영양으로 체내 immunoglobulin A의 70%를 생산하는 mucosal-associated lymphoid tissue의 기능을 유지시킬 수 있고 T 림프구 및 B 림프구가 gut-associated lymphoid tissue (GALT)로 들어가 장내 각종 항원에 감작되어 활성화될 수 있도록 하기 때문이다.[5]
여기에서 주목할 점은 보상성 항염증반응증후군에 관련된 사항이다. 초기 전신염증반응증후군(Systemic Inflammatory Response Syndrome; SIRS)이 주로 다형핵 호중구(Polymorphonuclear leukocytes; PMN)에 의한 내재 염증 반응으로 이뤄진다면 보상성 항염증반응증후군의 경우 대부분 림프구에 의한 적응성 면역반응(Adaptive immune response)으로 보상성 항염증반응증후군이 신속하게 종료되지 않고 지나치게 지속되는 경우 감염에 노출되기 쉽고 창상치유에 장애가 발생하면서 다발성 장기부전에 이른다고 본다.[6] 그래서 면역이 억제되어 결국 악순환의 고리로 빠질 수 있는 보상성 항염증반응증후군 과정에서 면역을 높여주는 영양소를 사용하여 감염 합병증을 낮추고 창상 치유를 도우며 병원 재원 기간을 줄여줄 수 있는 전략이 필요한데, 이 때 사용되는 대표적인 영양소들이 글루타민(glutamine), 아르기닌(arginine)과 같은 아미노산 영양소, 다불포화 지방산(polyunsaturated fatty acid), 몇 가지 미네랄과 probiotics라고 할 수 있다.
글루타민(glutamine)은 mRNA의 CAA 및 CAG 코돈에 의해 생성되는 아미노산으로서 α-아미노기와 α-카르복실기를 지닌다. 평상시에는 인체 내, 특히 전체 생산양의 90% 정도를 골격근에서 자체 생산하므로 필수적이지 않지만 스트레스와 외상, 수술 등의 심한 이화대사(catabolic metabolism) 반응을 겪을 때에는 요구량이 생산량을 초과하기 때문에 필수적인 외부 공급을 요구한다(conditionally essential). 글루타민이 골격근에서 합성될 때 글루탐산(glutamate)과 암모니아로부터 glutamine synthetase 효소에 의해 생산되며, 우리가 섭취할 수 있는 여러 육류(소고기, 돼지고기, 닭고기 등)는 물론이고 콩, 밀, 양배추 등 야채에서도 얻을 수 있다. 의료용으로 사용될 수 있는 글루타민은 여러 아미노산 가운데 글루타민이 강화된 경장영양용 제제가 있고, 주사용으로 다른 아미노산과 함께 일정한 비율로 함유된 제품과 글루타민과 알라닌의 디펩티드 결합으로 수용성을 높여 물에서 불안정한 글루타민의 속성을 낮춘 제품도 있다.
글루타민은 매우 여러 기능을 가지고 있는데(Table 1), 그 중에서 스트레스의 상황에서 면역영양소로서의 작용은 콩팥에서 포도당생산(renal gluconeogenesis)을 할 때 일차 재료로 사용되어 탄소골격의 역할을 하고, 체내 항산화 글루타치온 생성 과정에서 속도를 결정하는 아미노산으로 작용한다는 것이다.[7] 아직 동물실험에서만 밝혀진 기능이지만 스트레스 상황에서 인슐린 저항성을 낮추는 역할도 보고되었다.[8] 글루타민의 또 다른 이로운 역할로서 밝혀진 것이 있다면 열충격단백질(heat shock proteins)의 유도이다. 열충격단백질은 손상에 대한 세포 생존능력을 높여주고 염증반응 및 산화손상을 약화시키는 단백질로서 스트레스 상황에서 세포질 내에 많이 나타나 장기 부전을 막아준다.
Table 1
Biochemical functions of glutamine
면역영양소로서의 글루타민을 이용한 임상실험은 과거 10여년간 매우 활발히 진행되었고 또한 진행되고 있다. 초기에는 글루타민의 긍정적인 효과에 대해 의문이 제기되기도 하였으나 최근에 조금씩 그 적절한 적응증과 용법이 밝혀지고 있다.
글루타민을 이용한 여러 임상실험을 비교할 때 경장 글루타민 공급만을 비교하는 연구그룹과 경정맥 글루타민을 공급을 통한 비교연구를 시도한 그룹, 경장 및 경정맥 공급 모두를 사용한 연구 등 매우 다양한 형태의 연구 디자인들이 있기 때문에 이들의 연구 결과를 단순 비교 하는데 어려움이 있다. 글루타민은 정맥 공급을 할 경우 경장공급을 하였을 때보다 일관된 혈중 농도 및 효과를 보일 수 있기 때문에 정맥 공급을 통한 연구 결과들을 비교하는 것이 좀 더 편향 오류를 줄일 수 있다고 알려져 있으나 일반 경장영양을 시행하면서 정맥을 통한 글루타민을 준 그룹과 안 주는 그룹의 비교에서 그 효과의 차이가 감쇠할 수 있고 연구 디자인 마다 공급된 글루타민의 용량이 일정하지 않아 비교에 어려움이 있으며, 경장영양을 통해 글루타민 강화 제제를 공급하는 연구를 계획하더라도 혈중 농도의 목표에 도달할 수 있을 정도의 농축강화제제를 만드는 것이 쉽지 않은 한계점이 있는 등 글루타민의 효과를 검증하는 임상 연구에 많은 어려움이 있는 상황이다.
초기 1997년을 시작으로 정맥 및 경장 글루타민을 함께 사용한 연구들의 결과는 일반 영양공급에 비해 감염 합병증의 감소 및 중환자실에서의 회복이 빨라지는 효과를 보고하였다. 비록 이러한 결과들이 소규모 단일기관의 초기 연구에 대한 메타분석이었으나 빠르게 중환자에게 경장 글루타민의 사용을 권고하는 가이드라인에 반영되었다.[9-11]
하지만 최근에 이뤄진 코크레인 데이터베이스를 이용한 체계적 메타분석에 따르면 사망률의 감소 효과는 찾아보기 어려웠고 어느 정도 편향오류를 인정하더라도 중등도 정도의 합병증 감소 효과는 확인이 가능하였다.[12] 좀 더 최근에 두 개의 대규모 다기관 임상실험이 있었는데, 한 가지는 REDOX (the Reducing Deaths Due to Oxidative Stress) 실험이고 또 한 가지는 MetaPlus 실험이다.[13,14] 이 중요한 두 가지 대규모 전향적 실험에서 얻어진 결과는 글루타민의 공급이 중환자의 감염 합병증을 감소시키기는 커녕 장기 사망율을 증가시켰고, 각종 가이드라인에서 경장 혹은 경정맥 글루타민의 공급을 권유하는 것에 대하여 안전성 문제를 부각시키게 하였다. van Zanten 등[15]은 경장 글루타민 공급과 관련되어 메타분석을 통해 중증 트라우마 환자에게 글루타민 공급은 도움이 안 되며, 중증 화상 환자에게는 사망율을 낮추고 병원 재원 기간을 의미있게 줄일 수 있다고 결론 내리고 있다. 또 다른 전향적 연구에서는 경장 글루타민의 공급으로 위장관 관련 내독소 레벨을 낮추고 그램 음성균에 의한 패혈증을 막아줄 수 있다는 보고도 있다.[16]
이상의 여러 경장 영양을 통한 글루타민의 공급에 대한 연구들을 종합적으로 요약하면 경장영양이 가능한 환자, 특히 중증 화상 환자에게 경장 글루타민 강화 제제의 공급으로 위장관의 면역기능을 유지시키고 내독소나 세균성 패혈증을 낮출 수 있다.
정주 글루타민 공급에 관해서 경장 글루타민과 달리 여러 메타분석에서 그 잇점을 이야기하고 있다. 무엇보다도 중환자실에 급성 질환으로 입원하는 환자의 25∼30%에서 혈중 글루타민의 농도가 떨어지는 것을 확인할 수 있고 낮은 혈중 글루타민 농도는 안 좋은 예후를 나타내는 독립변수로 작용할 수 있어서[13,17,18] 글루타민 공급의 효과를 쉽게 검증할 수 있을 것 같지만 과거 시행된 글루타민 관련 연구들이 그런 결과를 밝히지 못 한 이유에는 몇 가지 원인이 있다. 첫째, 연구에 사용된 글루타민의 공급량이 너무 적은 경우가 많았고, 둘째, 다른 일반적인 정맥영양이나 경장영양이 진행되면서 글루타민이 뒤늦게 투여되는 경우 순수한 글루타민의 효과를 검증하는데 어려움이 있었고, 셋째, 종양환자는 종양효과로 인한 글루타민 결핍이 올 수 있는데도 연구 대상에 포함이 되었고, 그 반대로 신부전, 간부전 환자는 글루타민 처방에 제한이 따랐기 때문에 연구에서 제외되는 등의 선택편향의 오류가 많았다. 이러한 선택편향의 오류를 극복하기 위해 1,200명 이상의 장기부전을 포함하는 다기관 중환자를 대상으로 글루타민의 약리학적 처방용량(0.6∼0.8 g/kg/day)과 항산화 요법을 함께 하는 대규모 전향적 무작위 연구(REducing Deaths due to OXidative Stress; REDOXS trial)가 시행되었고,[19] 그 결과는 놀랍게도 기존의 많은 연구 결과와 달리 글루타민의 공급이 사망율을 더 높일 수 있다는 것을 보여주었다. 특히 주목할 사항은 REDOXS연구에서 30% 이상의 환자가 입원 당시 어느 정도 이상의 신부전증의 상황이었다는 점이 이전의 임상연구와 크게 차이가 나는 점이다. 이후 가장 최근에 500명 이상의 대규모 중환자를 대상으로 이뤄진 영국의 실험(SIGNET; Scottish Intensive care Glutamine or seleNium Evaluative Trial)에서는 적은 용량의 글루타민과 셀레늄을 함께 사용하였고 셀레늄의 새로운 감염 감소 효과는 있었지만 글루타민으로 인한 긍정적 효과는 확인할 수 없었다.[20]
여러 요인으로 정맥용 글루타민은 아직까지 미국 내에서의 생산, 판매 및 사용이 허락되어 있지 않다. 하지만 미국을 제외한 전 세계에서 정맥 글루타민 제제의 효과를 검증하기 위한 다양한 임상 실험이 진행되고 있고 다양한 임상 실험에도 불구하고 아직 모르는 것이 더 많다고 할 수 있다. 현재까지 밝혀진 몇 가지 글루타민의 기전은 장절제 후 장관의 적응에 도움이 되고 장점막, 췌장의 위축을 예방하여 허혈, 항암요법, 방사선 치료 등의 손상에서 위장관 기능 유지에 기여한다는 점이다. 또한 신부전, 간부전이 없는 상황에서 0.5 g/kg/day 이하의 용량은 안전하게 사용할 수 있고 감염, 사망률, 중환자실이나 병원 재원 기간의 감소에 기여할 수 있다.
아르기닌도 글루타민과 마찬가지로 조건부 필수 아미노산에 해당한다. CGU, CGC, CGA, CGG, AGA 및 AGG 코돈에 대응하여 생성되는 아미노산으로서 분자 구조상 α-아미노기와 α-카르복실기 그리고 3개의 탄소로 이뤄진 지방족 체인과 그 끝단에 구아니듐으로 이뤄진 전하를 띤 지방족 아미노산이다. 미숙아의 경우 체내 생산이 안 되어 외부 공급이 필수적이고 일반 성인에서 결핍이 발생하지 않으나 글루타민과 같이 외상 및 질병과 같은 스트레스 상황에서 수요가 공급을 능가하여 조건부 필수성을 보인다. 또한 이러한 조건부 결핍의 현상에 글루타민이나 시트룰린의 전달 메카니즘이 밀접하게 연관되어 있다고 본다(Fig. 2).[21]
아르기닌의 기능은 세포의 성장과 증식에 중요한 폴리아민(polyamine) 생합성과 프로라인(proline) 합성(창상 치유 및 콜라겐 합성)에 중요한 관여를 하고 산화질소(nitric oxide) 생산에 있어 유일한 재료이다. 산화질소를 만드는 NO synthase 효소에는 3가지 isoform, eNOS, iNOS, nNOS가 있다. 또한 성장호르몬, 프로락틴과 인슐린과 같은 동화 호르몬(anabolic hormone)의 분비를 자극하고 T-림프구의 활성화 및 증식을 유도한다. 인체에서 평상시 L-아르기닌을 유지하는 원천은 섭취 음식을 통하거나 Fig. 2와 같이 콩팥에서 우레아 순환(urea cycle)을 통해 시트룰린의 체내 대사로 합성 생산된다.
각종 외과적 수술이나 트라우마에 의한 스트레스가 닥치면 아르기닌의 섭취 혹은 체내 생성에 제한이 오면서 결핍을 겪을 수 있고, 동시에 스트레스 상황에서 골수로부터 혈류로 흘러드는 미성숙 골수억제세포(immature myeloid-derived suppressor cells)들은 많은 양의 arginase-1 효소를 배출하여 혈중 아르기닌을 빠르게 분해한다. 여러 조직에서 아르기닌의 요구량은 증가하지만 동시에 증가된 arginase-1 혹은 arginase-2 효소들이 빠르게 아르기닌을 우레아와 오르니틴으로 분해하며, iNOS 효소에 의해서는 아르기닌이 산화질소(NO)와 시트룰린으로 분해되어 결국 상대적인 아르기닌 결핍 상태에 이르고 이 현상은 T 림프구 기능과 증식이 억제되는 결과를 초래한다.[22] 이러한 면역결핍의 결과는 중증 외과환자의 증가된 감염위험도로 이어진다. 하지만 여러 질병의 복잡한 변화 및 대사반응 때문에 몇 가지 아미노산의 대사 과정을 일반화하여 기술하기는 매우 어렵다. 따라서 아르기닌의 경우에도 결핍의 결과를 예방하기 위해 단순히 공급을 하면 해결된다는 생각은 쉽게 검증될 수 없고 현실적으로도 올바르지 않다. 동물실험이나 인체실험에서 아르기닌의 공급이 도움이 된다는 의견과 공급으로 해를 끼칠 수 있다는 의견이 함께 있어 논란이 많았으나 가장 최근 보고에 따르면 오메가-3 지방산 등의 면역영양소와 함께 공급할 때 감염의 위험도를 낮추고 재원 기간을 단축시킨다는 결론이다.[23]
이처럼 여러 면역 영양소 가운데 아르기닌 만큼 논란의 중심에 있는 영양소도 없을 것으로 보이며 이론적으로 수술 후 혹은 패혈증 쇼크의 환자는 iNOS 효소의 활성도가 증가되어 있는 상황이기 때문에 아르기닌을 공급하면 산화질소의 증가로 이어져 가뜩이나 불안정한 혈역학적 상태가 더욱 악화되어 장기부전의 결과를 초래할 것으로 추정되기 때문이다. 그러나 이런 추정은 임상적으로 혈관 확장을 막기 위해 비선택적인 NO synthase inhibitor를 고용량으로 투여하더라도 혈역학적 불안정성이 개선되지 못 하였고, 28일 사망률도 더 높았기 때문에 근거있는 추정이 되지 못 하였다. 대신에 오히려 조절 가능한 혈관의 확장은 중환자의 패혈증성 쇼크에서 도움이 될 수 있다고 볼 수 있고, 쇼크의 정의에 따르면 ‘정상적인 조직 및 세포 기능을 수행하는데 필요한 산소 및 영양소가 적당하게 전달되지 못 하는 상태’라고 봤을 때 아르기닌을 투여함으로써 발생하는 혈관 확장은 세포의 정상적인 방어기전이라고 이해할 수 있다. 따라서 여러 학자들은 아르기닌과 대표적 NO synthase inhibitor라고 할 수 있는 Asymmetric dimethyl arginine (이하 ADMA)과의 비율이 혈관 내피(endothelium) 및 심기능의 변화에 매우 긴밀한 연관성을 가지고 있다고 발표하고, 아르기닌이 많고 ADMA가 적으면 패혈증에서 사망률이 개선되며, 그 반대일 경우 장기 부전 및 심장 기능의 저하가 발생한다고 하였다.[24] 그래서 패혈증의 상황에서 아르기닌이나 시트룰린의 저하가 발생하며, 아르기닌의 공급으로 도움이 될 수 있다고 Luiking 등[22]과 Kao 등[25]이 보고하였다.
아르기닌의 섭취는 여러 경로를 통해 가능하며 하루 체내 생산되는 15∼20 g의 아르기닌의 약 1/3되는 양을 섭취한다. 하루 30 g까지 섭취를 해도 안전한 범위로 여겨지지만 통상적으로 생산되는 경장 영양 제품에는 이 양의 절반 정도 함유된 것으로 알려져 있다.
생선유 및 핵산 등의 다른 면역 영양소와의 상호 작용에 대해서는 잘 알려져 있지 않거나 아르기닌 대사에 심각한 변화를 초래할 수 있다고 보고되고 있어서 되도록 함께 사용하지 않을 것을 권고하고 있다.[26]
그 밖에 면역영양소로 사용될 수 있는 아미노산에는 시트룰린과 류신 정도 거론할 수 있다. 그러나 시트룰린의 경우에는 앞서 거론된 글루타민과 아르기닌의 대사 과정에 관여하기 때문에 이미 면역 영양소로서의 역할에 대해 어느 정도 인지되고 있었고, 류신의 경우에는 좀 다른 역할로서 작용한다고 할 수 있다.
먼저 류신에 대해 살펴보면 류신은 아이소류신(Isoleucine), 발린(Valine)과 함께 3대 측쇄아미노산(Branched Chain Amino Acid, BCAA)에 속한다. 측쇄아미노산은 골격근에서 대사되고 간대사를 거치지 않는다고 하여 간질환 환자의 영양 공급에 사용이 권장되고 있다. 특히 류신은 여러 식이 아미노산 가운데 유일하게 세포의 성장을 촉진하며 골격근은 물론이고 내장근에서도 mTOR 경로를 통한 단백질 합성을 자극하는 기능을 가지고 있다.[27] 동물 실험에서도 경장영양을 통한 류신의 공급이 패혈증 모델 rat에서 단백질 합성을 자극하였다는 보고가 있어서 패혈증에서의 골격근 이화반응에 대한 대처로서 영양지원 시 류신을 포함하는 것이 도움이 될 수 있다.
과거 중환자에 대한 측쇄아미노산의 효과에 대한 연구가 진행되어 왔으나 대부분의 연구가 아이소류신이나 발린에 촛점이 맞춰져 있었고 류신은 그저 첨가되는 형식에 그쳐 왔다. 하지만 골격근 이화작용을 줄여주거나 막아줄 수 있는 효과가 밝혀진 류신에 대한 새로운 관점이 필요한 시기이고 류신 단독 효과에 대한 연구도 중요하지만 글루타민과 같은 면역 영양소와 함께 류신을 이용한 근육이화반응을 조절할 수 있다면 또 다른 결과를 밝힐 수 있는 일이라고 제안할 수 있다.
시트룰린의 경우 앞서 언급한 바와 같이 섭취된 글루타민은 소장의 일차 에너지원으로서 흡수되어 사용되며 장의 기능을 향상 및 유지하는데 기여한다. 소장 장점막 세포는 글루타민을 시트룰린으로 전환하고 간문맥을 통해 간을 거쳐 체내 순환을 거쳐 콩팥으로 흘러 들어간 시트룰린은 아르기닌과 산화질소로 전환되는데 사용된다.[28]
그래서 시트룰린을 따로 공급하는 것에 대한 잇점이 밝혀진 바는 별로 없고 건강 보조식품으로서 류마티즘이나 남성의 발기장애에 도움이 될 수 있다고 알려져 있을 뿐 임상적인 효능에 대해 그 다지 활발한 연구가 진행되고 있지 않다. 중환자의 영양치료에 있어서 글루타민을 공급함으로써 체내 시트룰린의 합성을 촉진할 수 있다는 점과 아직 동물 실험에서만 알려져 있는 사항으로 단장증후군, 흡수장애가 있는 경우 영양공급에 시트룰린이 포함되면 도움이 될 수 있다는 정도이다.
결론
단백질을 이루는 아미노산 가운데 가장 풍부한 양을 가지고 있는 글루타민은 장의 기능, 투과성 유지, 면역 기능의 수행에서 매우 중요한 역할을 하므로 패혈증이나 중증 질환으로 수요가 공급을 능가하는 시점에서의 적절한 공급으로 적정성이 유지된다면 중환자의 감염 합병증을 낮추고 치료 기간을 줄이는데 도움이 될 수 있다.
아르기닌의 경우에도 단독 사용이 아닌 여러 단백 아미노산 영양소와 함께 적절한 용량이 공급되면 패혈증 쇼크 등에서 도움이 될 수 있으나 아직 특정 면역 영양소와 함께 단독 사용된 경우에 발생할 수 있는 상호작용에 대해 알려진 바가 없다.
류신이나 시트룰린의 경우 이제 서서히 그 실체와 작용이 밝혀지기 시작한 단계의 영양소로서 아직 확실하게 그 기전이 알려져 있지 않다.
면역영양소로서의 아미노산의 역할은 인체의 대부분을 구성하는 단백질의 한 요소로서 그 중요성이 매우 높다. 하지만 최근 각광을 받고 있는 오메가-3 지방산과 핵산, 각종 미네랄과의 기대되는 상승효과나 상호작용 및 부작용에 대해서는 아직도 많은 연구가 필요하다.
- 1. Pingleton SK. Enteral nutrition and infection in the intensive care unit. Semin Respir Infect 1990;5:185-90.ArticlePubMed
- 2. Cerra FB. Hypermetabolism, organ failure, and metabolic support. Surgery 1987;101:1-14.ArticlePubMed
- 3. Alexander JW, MacMillan BG, Stinnett JD, Ogle CK, Bozian RC, Fischer JE, et al. Beneficial effects of aggressive protein feeding in severely burned children. Ann Surg 1980;192:505-17.ArticlePubMedPMC
- 4. Hassoun HT, Kone BC, Mercer DW, Moody FG, Weisbrodt NW, Moore FA. Post-injury multiple organ failure:the role of the gut. Shock 2001;15:1-10.Article
- 5. Kang W, Kudsk KA, Sano Y, Lan J, Yang-Xin F, Gomez FE, et al. Effects of lymphotoxin beta receptor blockade on intestinal mucosal immunity. JPEN J Parenter Enteral Nutr 2007;31:358-64; discussion 364-5.ArticlePubMed
- 6. Bone RC. Sir Isaac Newton, sepsis, SIRS, and CARS. Crit Care Med 1996;24:1125-8.ArticlePubMed
- 7. Grau T, Bonet A, Miñambres E, Piñeiro L, Irles JA, Robles A, et al. The effect of L-alanyl-L-glutamine dipeptide supplemented total parenteral nutrition on infectious morbidity and insulin sensitivity in critically ill patients. Crit Care Med 2011;39:1263-8.ArticlePubMed
- 8. Wernerman J, Kirketeig T, Andersson B, Berthelson H, Ersson A, Friberg H, et al. Scandinavian glutamine trial:a pragmatic multi-centre randomised clinical trial of intensive care unit patients. Acta Anaesthesiol Scand 2011;55:812-8.ArticlePubMed
- 9. Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P. Canadian Critical Care Clinical Practice Guidelines C. Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr 2003;27:355-73.ArticlePubMed
- 10. Kreymann KG, Berger MM, Deutz NE, Hiesmayr M, Jolliet P, Kazandjiev G, et al. ESPEN guidelines on enteral nutrition:intensive care. Clin Nutr 2006;25:210-23.ArticlePubMed
- 11. McClave SA, Martindale RG, Vanek VW, McCarthy M, Roberts P, Taylor B, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient:Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2009;33:277-316.ArticlePubMed
- 12. Tao KM, Li XQ, Yang LQ, Yu WF, Lu ZJ, Sun YM, et al. Glutamine supplementation for critically ill adults. Cochrane Database Syst Rev 2014;9:CD010050.Article
- 13. Heyland D, Muscedere J, Wischmeyer PE, Cook D, Jones G, Albert M, et al. A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med 2013;368:1489-97.ArticlePubMed
- 14. van Zanten AR, Sztark F, Kaisers UX, Zielmann S, Felbinger TW, Sablotzki AR, et al. High-protein enteral nutrition enriched with immune-modulating nutrients vs standard high-protein enteral nutrition and nosocomial infections in the ICU:a randomized clinical trial. JAMA 2014;312:514-24.ArticlePubMed
- 15. van Zanten AR, Dhaliwal R, Garrel D, Heyland DK. Enteral glutamine supplementation in critically ill patients:a systematic review and meta-analysis. Crit Care 2015;19:294.ArticlePubMedPMC
- 16. Schulman AS, Willcutts KF, Claridge JA, Evans HL, Radigan AE, O’Donnell KB, et al. Does the addition of glutamine to enteral feeds affect patient mortality?Crit Care Med. 2005;33:2501-6.ArticlePubMed
- 17. Oudemans-van Straaten HM, Bosman RJ, Treskes M, van der Spoel HJ, Zandstra DF. Plasma glutamine depletion and patient outcome in acute ICU admissions. Intensive Care Med 2001;27:84-90.ArticlePubMedPDF
- 18. Rodas PC, Rooyackers O, Hebert C, Norberg Å, Wernerman J. Glutamine and glutathione at ICU admission in relation to outcome. Clin Sci (Lond) 2012;122:591-7.ArticlePubMedPMCPDF
- 19. Heyland DK, Dhaliwal R, Day AG, Muscedere J, Drover J, Suchner U, et al. REducing Deaths due to OXidative Stress (The REDOXS Study):rationale and study design for a randomized trial of glutamine and antioxidant supplementation in critically-ill patients. Proc Nutr Soc 2006;65:250-63.ArticlePubMed
- 20. Andrews PJ, Avenell A, Noble DW, Campbell MK, Croal BL, Simpson WG, et al. Randomised trial of glutamine, selenium, or both, to supplement parenteral nutrition for critically ill patients. BMJ 2011;342:d1542.ArticlePubMed
- 21. Deutz NE. The 2007 ESPEN Sir David Cuthbertson lecture:amino acids between and within organs. The glutamate-glutamine-citrulline-arginine pathway. Clin Nutr 2008;27:321-7.ArticlePubMed
- 22. Luiking YC, Poeze M, Ramsay G, Deutz NE. Reduced citrulline production in sepsis is related to diminished de novo arginine and nitric oxide production. Am J Clin Nutr 2009;89:142-52.ArticlePubMed
- 23. Drover JW, Dhaliwal R, Weitzel L, Wischmeyer PE, Ochoa JB, Heyland DK. Perioperative use of arginine-supplemented diets:a systematic review of the evidence. J Am Coll Surg 2011;212:385-99; 399 e1.ArticlePubMed
- 24. Visser M, Vermeulen MA, Richir MC, Teerlink T, Houdijk AP, Kostense PJ, et al. Imbalance of arginine and asymmetric dimethylarginine is associated with markers of circulatory failure, organ failure and mortality in shock patients. Br J Nutr 2012;107:1458-65.ArticlePubMed
- 25. Kao CC, Bandi V, Guntupalli KK, Wu M, Castillo L, Jahoor F. Arginine, citrulline and nitric oxide metabolism in sepsis. Clin Sci (Lond) 2009;117:23-30.ArticlePubMedPDF
- 26. Bansal V, Syres KM, Makarenkova V, Brannon R, Matta B, Harbrecht BG, et al. Interactions between fatty acids and arginine metabolism:implications for the design of immune-enhancing diets. JPEN J Parenter Enteral Nutr 2005;29:S75-80.ArticlePubMedPDF
- 27. Woods SC, Seeley RJ, Cota D. Regulation of food intake through hypothalamic signaling networks involving mTOR. Annu Rev Nutr 2008;28:295-311.ArticlePubMed
- 28. Marini JC. Interrelationships between glutamine and citrulline metabolism. Curr Opin Clin Nutr Metab Care 2016;19:62-6.ArticlePubMedPMC
References
Figure & Data
REFERENCES
Citations
Citations to this article as recorded by 

Immunonutrition and Amino Acids
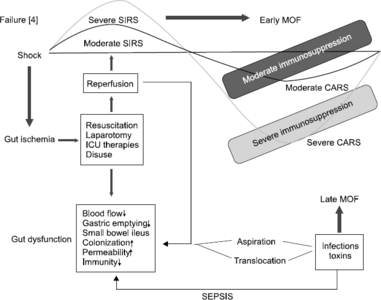
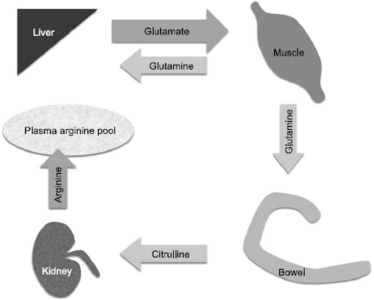
Fig. 1
Systemic inflammatory response syndrome and gut in the course of multiorgan failure [4].
Fig. 2
Interorgan transport of glutamate, glutamine, citrulline and arginine (Adapted from [20]).
Fig. 1
Fig. 2
Immunonutrition and Amino Acids
Biochemical functions of glutamine
| 1. Protein synthesis |
| 2. Lipid synthesis by cancer cells |
| 3. Primary oxidative fuel for rapidly dividing tissue, such as small bowel mucosa, lymphocytes, macrophages |
| 4. Maintenance of acid-base status |
| 5. Precursor of urinary ammonia |
| 6. Inter-organ nitrogen transfer for the biosynthesis of nucleotides, amino sugars, arginine, glutathione, glucosamine |
Table 1 Biochemical functions of glutamine

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN
 Cite
Cite

