Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 10(2); 2019 > Article
- ORIGINAL ARTICLE Relationship of Sarcopenia with the Outcomes of Patients who Underwent Surgery for Bile Duct Cancer
- Hye Jin Kim, M.D., Min-Su Park, M.D., Ph.D., Bum-Soo Kim, M.D., Ph.D., Sang-Mok Lee, M.D., Ph.D.
- 담도암으로 수술을 시행한 환자에서 예후와 근감소증의 관계
- 김혜진, M.D., 박민수, M.D., Ph.D., 김범수, M.D., Ph.D., 이상목, M.D., Ph.D.
-
Surgical Metabolism and Nutrition 2019;10(2):54-58.
DOI: https://doi.org/10.18858/smn.2019.10.2.54
Published online: December 30, 2019
Department of Surgery, School of Medicine, Kyung Hee University, Seoul, Korea
- Correspondence to: Min-Su Park, Department of Surgery, School of Medicine, Kyung Hee University, 23 Kyungheedae-ro, Dongdaemun-gu, Seoul 02447, Korea Tel: +82-2-958-8250, Fax: +82-2-966-9366, E-mail: ikireida@hanmail.net
Copyright: © The Korean Society of Surgical Metabolism and Nutrition
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 1,119 Views
- 5 Download
- 1 Crossref
Abstract
-
Purpose: This study investigated the impact of Sarcopenia by examining the psoas muscle on the outcomes after bile duct resection for bile duct cancer.
-
Materials and Methods: This study retrospectively analyzed 101 patients who underwent surgery for bile duct cancer between January 2006 and December 2015 at Kyung-Hee University Hospital. Skeletal muscle mass was evaluated by performing preoperative computed tomography to define Sarcopenia. Patients were classified into two groups by the median value of the psoas muscle index (PMI).
-
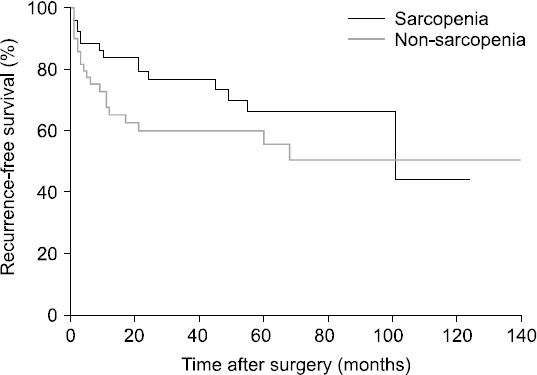
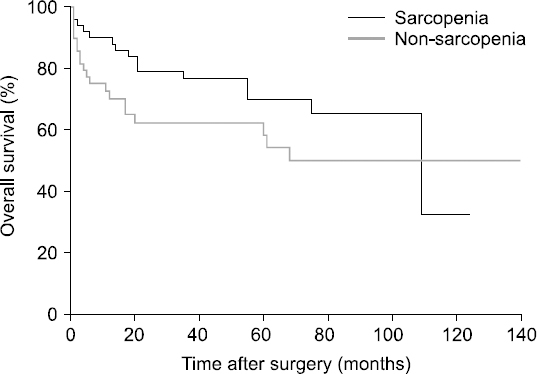
Results: The median value of the psoas muscle index in female patients was 463.9 mm2/m2, and the median value of the psoas muscle index in males was 688.7 mm2/m2. In the sarcopenia group, the 1, 3, and 5-year recurrence free survival rates were 74.5%, 52.9%, and 27.5%, respectively. On the other hand, in the non-sarcopenia group the 1, 3, and 5-year recurrence free survival rates were 50%, 34%, and 28%, respectively. In the sarcopenia group, the 1, 3, and 5-year overall survival rates were 84.3%, 54.9%, and 31.4%, respectively. In the non-sarcopenia group, 1, 3, and 5-year overall survival rates were 58%, 40%, and 32%, respectively. However, recurrence-free survival and overall survival were not correlated with sarcopenia (P=0.131, P=0.163).
-
Conclusion: Sarcopenia using the psoas muscle index (PMI) has no impact on outcomes of bile duct cancer patients who underwent surgery. (Surg Metab Nutr 2019;10:-58)
서 론
대상 및 방법
결 과
고 찰
결 론
- 1. Jang JY, Kim SW, Park DJ, Ahn YJ, Yoon YS, Choi MG, et al. Actual long-term outcome of extrahepatic bile duct cancer after surgical resection. Ann Surg 2005;241:77-84. ArticlePubMedPMC
- 2. Bhuiya MR, Nimura Y, Kamiya J, Kondo S, Fukata S, Hayakawa N, et al. Clinicopathologic studies on perineural invasion of bile duct carcinoma. Ann Surg 1992;215:344-9. ArticlePubMedPMC
- 3. Dempsey DT, Mullen JL, Buzby GP. The link between nutritional status and clinical outcome:can nutritional intervention modify it? Am J Clin Nutr 1988;47(2 Suppl):352-6. ArticlePubMed
- 4. Bharadwaj S, Ginoya S, Tandon P, Gohel TD, Guirguis J, Vallabh H, et al. Malnutrition:laboratory markers vs nutritional assessment. Gastroenterol Rep (Oxf) 2016;4:272-80. ArticlePubMedPMC
- 5. Correa-de-Araujo R, Hadley E. Skeletal muscle function deficit:a new terminology to embrace the evolving concepts of sarcopenia and age-related muscle dysfunction. J Gerontol A Biol Sci Med Sci 2014;69:591-4. ArticlePubMedPMC
- 6. Vellas B, Fielding RA, Bens C, Bernabei R, Cawthon PM, Cederholm T, et al. Implications of ICD-10 for sarcopenia clinical practice and clinical trials:report by the International Conference on Frailty and Sarcopenia Research Task Force. J Frailty Aging 2018;7:2-9. ArticlePubMed
- 7. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T. Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia:revised European consensus on definition and diagnosis. Age Ageing 2019;48:16-31. ArticlePubMedPDF
- 8. Andreoli A, Scalzo G, Masala S, Tarantino U, Guglielmi G. Body composition assessment by dual-energy X-ray absorptiometry (DXA). Radiol Med 2009;114:286-300. ArticlePubMedPDF
- 9. Achamrah N, Colange G, Delay J, Rimbert A, Folope V, Petit A, et al. Comparison of body composition assessment by DXA and BIA according to the body mass index:a retrospective study on 3655 measures. PLoS One 2018;13:e0200465.ArticlePubMedPMC
- 10. Lee SY, Gallagher D. Assessment methods in human body composition. Curr Opin Clin Nutr Metab Care 2008;11:566-72. ArticlePubMedPMC
- 11. Otsuji H, Yokoyama Y, Ebata T, Igami T, Sugawara G, Mizuno T, et al. Preoperative sarcopenia negatively impacts postoperative outcomes following major hepatectomy with extrahepatic bile duct resection. World J Surg 2015;39:1494-500. ArticlePubMedPDF
- 12. Kobayashi A, Kaido T, Hamaguchi Y, Okumura S, Shirai H, Yao S, et al. Impact of sarcopenic obesity on outcomes in patients undergoing hepatectomy for hepatocellular carcinoma. Ann Surg 2019;269:924-31. ArticlePubMed
- 13. Reisinger KW, van Vugt JL, Tegels JJ, Snijders C, Hulsewé KW, Hoofwijk AG, et al. Functional compromise reflected by sarcopenia, frailty, and nutritional depletion predicts adverse postoperative outcome after colorectal cancer surgery. Ann Surg 2015;261:345-52. ArticlePubMed
- 14. Huang DD, Wang SL, Zhuang CL, Zheng BS, Lu JX, Chen FF, et al. Sarcopenia, as defined by low muscle mass, strength and physical performance, predicts complications after surgery for colorectal cancer. Colorectal Dis 2015;17:O256-64. ArticlePubMed
- 15. El Amrani M, Vermersch M, Fulbert M, Prodeau M, Lecolle K, Hebbar M, et al. Impact of sarcopenia on outcomes of patients undergoing pancreatectomy:a retrospective analysis of 107 patients. Medicine (Baltimore) 2018;97:e12076.ArticlePubMedPMC
- 16. Nagata T, Nakase Y, Nakamura K, Sougawa A, Mochiduki S, Kitai S, et al. Prognostic impact of a nutritional index including muscle volume in stage 4 colorectal cancer. In Vivo 2016;30:885-91. ArticlePubMed
- 17. Ishii N, Iwata Y, Nishikawa H, Enomoto H, Aizawa N, Ishii A, et al. Effect of pretreatment psoas muscle mass on survival for patients with unresectable pancreatic cancer undergoing systemic chemotherapy. Oncol Lett 2017;14:6059-65. ArticlePubMedPMC
- 18. van Vugt JLA, Gaspersz MP, Vugts J, Buettner S, Levolger S, de Bruin RWF, et al. Low skeletal muscle density is associated with early death in patients with perihilar cholangiocarcinoma regardless of subsequent treatment. Dig Surg 2019;36:144-52. ArticlePubMedPDF
- 19. Schweitzer L, Geisler C, Pourhassan M, Braun W, Glüer CC, Bosy-Westphal A, et al. What is the best reference site for a single MRI slice to assess whole-body skeletal muscle and adipose tissue volumes in healthy adults? Am J Clin Nutr 2015;102:58-65. ArticlePubMed
References
Figure & Data
REFERENCES
Citations

- Sarcopenia increases the risk of major organ or vessel invasion in patients with papillary thyroid cancer
Ja Kyung Yoon, Jung Hyun Yoon, Vivian Youngjean Park, Minah Lee, Jin Young Kwak
Scientific Reports.2022;[Epub] CrossRef
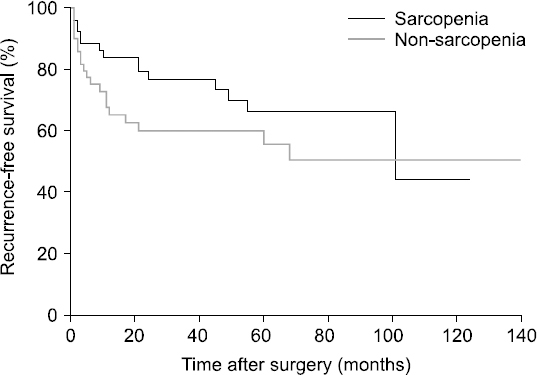
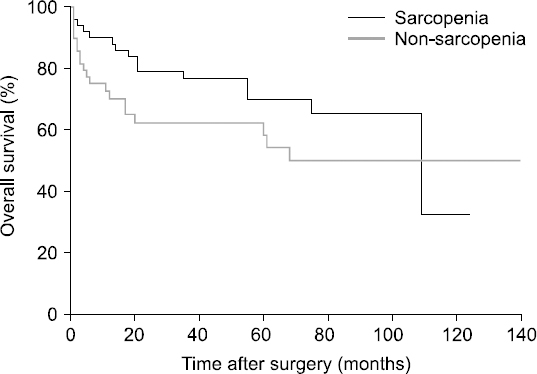
Fig. 1
Fig. 2
Characteristics of patients included in the study
| Characteristic | Sarcopenia (n=51) | Non-sarcopenia (n=50) | P-value | |
|---|---|---|---|---|
| Age | 63.9 (10.1) | 63.4 (8.44) | 0.780 | |
| Sex (%) | Female | 18 (35.3%) | 18 (36%) | 0.941 |
| Male | 33 (64.7%) | 32 (64%) | ||
| BMI | 22.8 (3.1) | 24.8 (2.69) | 0.001 | |
| PMI | 515.5 (120.6) | 742.9 (165.4) | 0.000 | |
| Total bilirubin | 2.4 (2.0) | 10.2 (51.1) | 0.279 | |
| AST | 62.4 (51.8) | 56.3 (35.4) | 0.493 | |
| ALT | 73.0 (66.1) | 56.3 (35.4) | 0.810 | |
| ALP | 227.6 (123.4) | 208.3 (151.8) | 0.485 | |
| GGT | 316.5 (298.5) | 391.1 (461.2) | 0.336 | |
| Albumin | 3.7 (0.4) | 3.7 (0.5) | 0.679 | |
| CA19-9 | 867.5 (2388.1) | 368.8 (1145.9) | 0.205 | |
| Lymphocyte counts/ratio | 31.9 (53.1) | 28.0 (8.1) | 0.609 | |
| Cell differentiation (%) | Well | 8 (17.3%) | 9 (21.4%) | 0.726 |
| Moderate | 30 (65.2%) | 28 (66.7%) | ||
| Poor | 8 (17.3%) | 5 (11.9%) | ||
| Lymph node metastasis (%) | None | 35 (85.3%) | 24 (63.1%) | 0.023 |
| Metastasis | 6 (14.6%) | 14 (36.8%) | ||
| Surgery (%) | PPPD | 24 (47.0%) | 30 (60%) | 0.356 |
| Whipple | 0 | 1 (2%) | ||
| BDR | 11 (21.6%) | 9 (18%) | ||
| ETC | 16 (31.4%) | 10 (20%) | ||
| Clavian-dindo classification (%) | 0 | 33 (64.8%) | 30 (60%) | 0.529 |
| 1 | 3 (5.9%) | 3 (6%) | ||
| 2 | 13 (25.5%) | 12 (24%) | ||
| 3 | 2 (3.9%) | 2 (4%) | ||
| 4 | 0 | 3 (6%) | ||
| TNM stage | 1, 2 | 46 | 46 | 0.716 |
| 3, 4 | 4 | 3 | ||
BMI = Body Mass Index; PMI = Psoas Muscle Index; PPPD = Pylorus Preserving PancreatoDuodenectomy; BDR = Bile Duct Resection.
BMI = Body Mass Index; PMI = Psoas Muscle Index; PPPD = Pylorus Preserving PancreatoDuodenectomy; BDR = Bile Duct Resection.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

