Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 11(1); 2020 > Article
- Original Article Status of Nutritional Support after Emergency Gastrointestinal Surgery in Korea: Retrospective Multicenter Study
- Dae Sang Lee, M.D.1, Young Eun Park, M.D.2, Kyoung Hoon Lim, M.D., Ph.D.3, Ye Rim Chang, M.D., Ph.D.4, Suk-Kyung Hong, M.D., Ph.D.5, Minchang Kang, M.D.6, Jung-Min Bae, M.D., Ph.D.7, Ji Young Jang, M.D., Ph.D.8, Young Goun Jo, M.D.9, Ki Hoon Kim, M.D.10, Gil Jae Lee, M.D., Ph.D.2
- 응급 위장관 수술 후 영양 공급 실태: 후향적 다기관 연구
- 이대상, M.D.1, 박영은, M.D.2, 임경훈, M.D., Ph.D.3, 장예림, M.D., Ph.D.4, 홍석경, M.D., Ph.D.5, 강민창, M.D.6, 배정민, M.D., Ph.D.7, 장지영, M.D., Ph.D.8, 조영권, M.D.9, 김기훈, M.D.10, 이길재, M.D., Ph.D.2
-
Surgical Metabolism and Nutrition 2020;11(1):1-6.
DOI: https://doi.org/10.18858/smn.2020.11.1.1
Published online: June 30, 2020
1Department of General Surgery, The Catholic University of Korea Uijeongbu St. Mary’s Hospital, Uijeongbu, Korea
2Department of Traumatology, Gil Medical Center, Gachon University College of Medicine, Incheon, Korea
3Department of General Surgery, Kyungpook National University Hospital, Daegu, Korea
4Department of Surgery, Trauma Center, Dankook University Hospital, Cheonan, Korea
5Division of Acute Care Surgery, Department of Surgery, Asan Medical Center, University of Ulsan College of Medicine, Seoul, Korea
6Department of Surgery, Soon Chun Hyang University Seoul Hospital, Seoul, Korea
7Department of Surgery, Yeungnam University Medical Center, Daegu, Korea
8Trauma Center, Department of Surgery, Wonju Severance Christian Hospital, Yonsei University Wonju College of Medicine, Wonju, Korea
9Division of Trauma Surgery, Department of Surgery, Chonnam National University Hospital and Medical School, Gwangju, Korea
10Department of Surgery, Inje University Haeundae Paik Hospital, Busan, Korea
- Correspondence to: Gil Jae Lee, Department of Traumatology, Gil Medical Center, Gachon University College of Medicine, 773 Namdong-daero, Namdong-gu, Incheon 21556, Korea Tel: +82-32-460-3010, Fax: +82-32-460-2372, E-mail: nonajugi@gilhospital.com
Copyright © 2020 The Korean Society of Surgical Metabolism and Nutrition
This is an open-access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 689 Views
- 2 Download
Abstract
-
Purpose Surgery itself causes an inflammatory response to an injury to the patient that leads to a stress metabolic state. Emergency gastrointestinal surgery may cause complications, such as ileus, bowel obstruction, ischemia, or anastomotic leakage, resulting in a delayed oral diet or poor overall nutrition. This study investigated the route of nutrition for patients who underwent emergency gastrointestinal surgery and when to provide nutrition after surgery.
-
Materials and Methods Ten hospitals collected data retrospectively on the nutritional status and nutritional status of patients undergoing emergency gastrointestinal surgery for one year from January to December 2016. The clinical outcomes of the nutrient supply method, duration of supply, and type of surgery were performed. The dates from the time of surgery to the start of enteral nutrition, oral nutrition, and parenteral nutrition were calculated.
-
Results Of 706 patients, there were 187 (26.5%) trauma patients, of which 63.5% were male. The onset of nutrition began after an average of 10.7 days postoperatively and after an average of 12.1 days of enteral nutrition. On average, it took 7.7 days to provide adequate calories, of which 63.3% had achieved adequate calories within a week. In the case of minimally invasive surgery, such as laparoscopic surgery, the adequate calorie supply time was five days, which was reached within one week.
-
Conclusion In a retrospective multicenter analysis, the patients who underwent emergency gastrointestinal surgery had a late start of oral or enteral nutrition, and the ratio of adequate calorie supply within a week was low.
서 론
대상 및 방법
결 과
고 찰
FIGURES AND TABLES
- 1. Gillis C, Carli F. Promoting perioperative metabolic and nutritional care. Anesthesiology 2015;123:1455-72. ArticlePubMedPDF
- 2. Alazawi W, Pirmadjid N, Lahiri R, Bhattacharya S. Inflammatory and immune responses to surgery and their clinical impact. Ann Surg 2016;264:73-80. ArticlePubMed
- 3. Yeh DD, Fuentes E, Quraishi SA, Cropano C, Kaafarani H, Lee J, et al. Adequate nutrition may get you home: effect of caloric/protein deficits on the discharge destination of critically ill surgical patients. JPEN J Parenter Enteral Nutr 2016;40:37-44. ArticlePubMed
- 4. Giner M, Laviano A, Meguid MM, Gleason JR. In 1995 a correlation between malnutrition and poor outcome in critically ill patients still exists. Nutrition 1996;12:23-9. ArticlePubMed
- 5. Koller M, Schütz T, Valentini L, Kopp I, Pichard C, Lochs H. Clinical Nutrition Guideline Group. Outcome models in clinical studies: implications for designing and evaluating trials in clinical nutrition. Clin Nutr 2013;32:650-7. ArticlePubMed
- 6. Ljungqvist O. ERAS--enhanced recovery after surgery: moving evidence-based perioperative care to practice. JPEN J Parenter Enteral Nutr 2014;38:559-66. ArticlePubMed
- 7. Gillis C, Nguyen TH, Liberman AS, Carli F. Nutrition adequacy in enhanced recovery after surgery: a single academic center experience. Nutr Clin Pract 2015;30:414-9. ArticlePubMed
- 8. Sørensen LT, Malaki A, Wille-Jørgensen P, Kallehave F, Kjaergaard J, Hemmingsen U, et al. Risk factors for mortality and postoperative complications after gastrointestinal surgery. J Gastrointest Surg 2007;11:903-10. ArticlePubMedPDF
- 9. Havens JM, Peetz AB, Do WS, Cooper Z, Kelly E, Askari R, et al. The excess morbidity and mortality of emergency general surgery. J Trauma Acute Care Surg 2015;78:306-11. ArticlePubMed
- 10. Lee SH, Jang JY, Kim HW, Jung MJ, Lee JG. Effects of early enteral nutrition on patients after emergency gastrointestinal surgery: a propensity score matching analysis. Medicine (Baltimore) 2014;93:e323. ArticlePubMedPMC
- 11. Khalili TM, Navarro RA, Middleton Y, Margulies DR. 2001;Early postoperative enteral feeding increases anastomotic strength in a peritonitis model. Am J Surg 182:621-4. ArticlePubMed
- 12. Singh G, Ram RP, Khanna SK. Early postoperative enteral feeding in patients with nontraumatic intestinal perforation and peritonitis. J Am Coll Surg 1998;187:142-6. ArticlePubMed
- 13. Shafi S, Aboutanos MB, Agarwal S Jr, Brown CVR, Crandall M, Feliciano DV, et al. AAST Committee on Severity Assessment and Patient Outcomes. Emergency general surgery: definition and estimated burden of disease. J Trauma Acute Care Surg 2013;74:1092-7. ArticlePubMed
- 14. Howes TE, Cook TM, Corrigan LJ, Dalton SJ, Richards SK, Peden CJ. Postoperative morbidity survey, mortality and length of stay following emergency laparotomy. Anaesthesia 2015;70:1020-7. ArticlePubMed
- 15. Tolstrup MB, Watt SK, Gögenur I. Morbidity and mortality rates after emergency abdominal surgery: an analysis of 4346 patients scheduled for emergency laparotomy or laparoscopy. Langenbecks Arch Surg 2017;402:615-23. ArticlePubMedPDF
- 16. Malhotra A, Mathur AK, Gupta S. Early enteral nutrition after surgical treatment of gut perforations: a prospective randomised study. J Postgrad Med 2004;50:102-6. ArticlePubMed
- 17. Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019;38:48-79. ArticlePubMed
- 18. Park CM. Nutritional support in critically ill surgical patients. J Korean Soc Parenter Enter Nutr 2013;5:15-9. Article
References
Figure & Data
REFERENCES
Citations

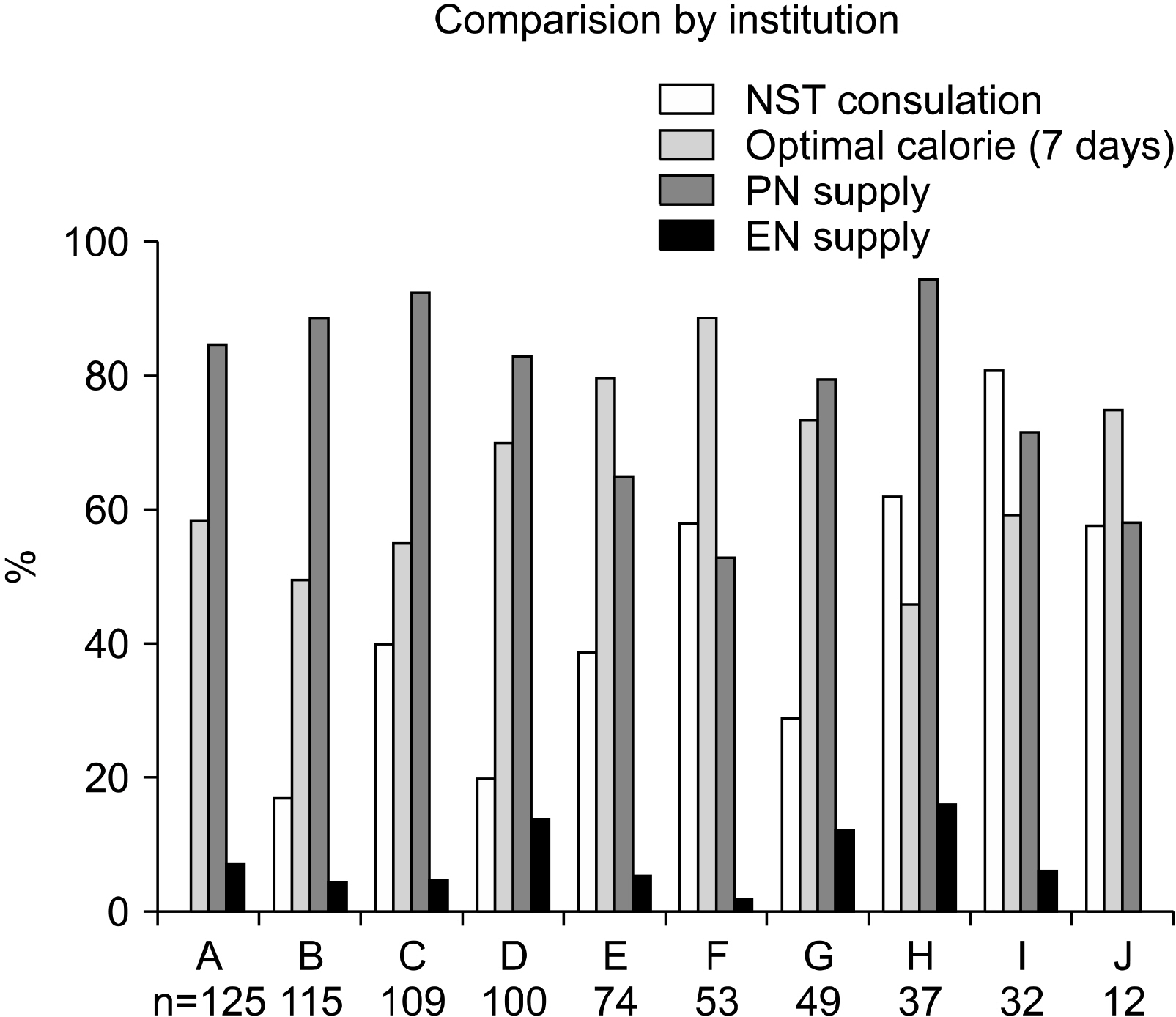
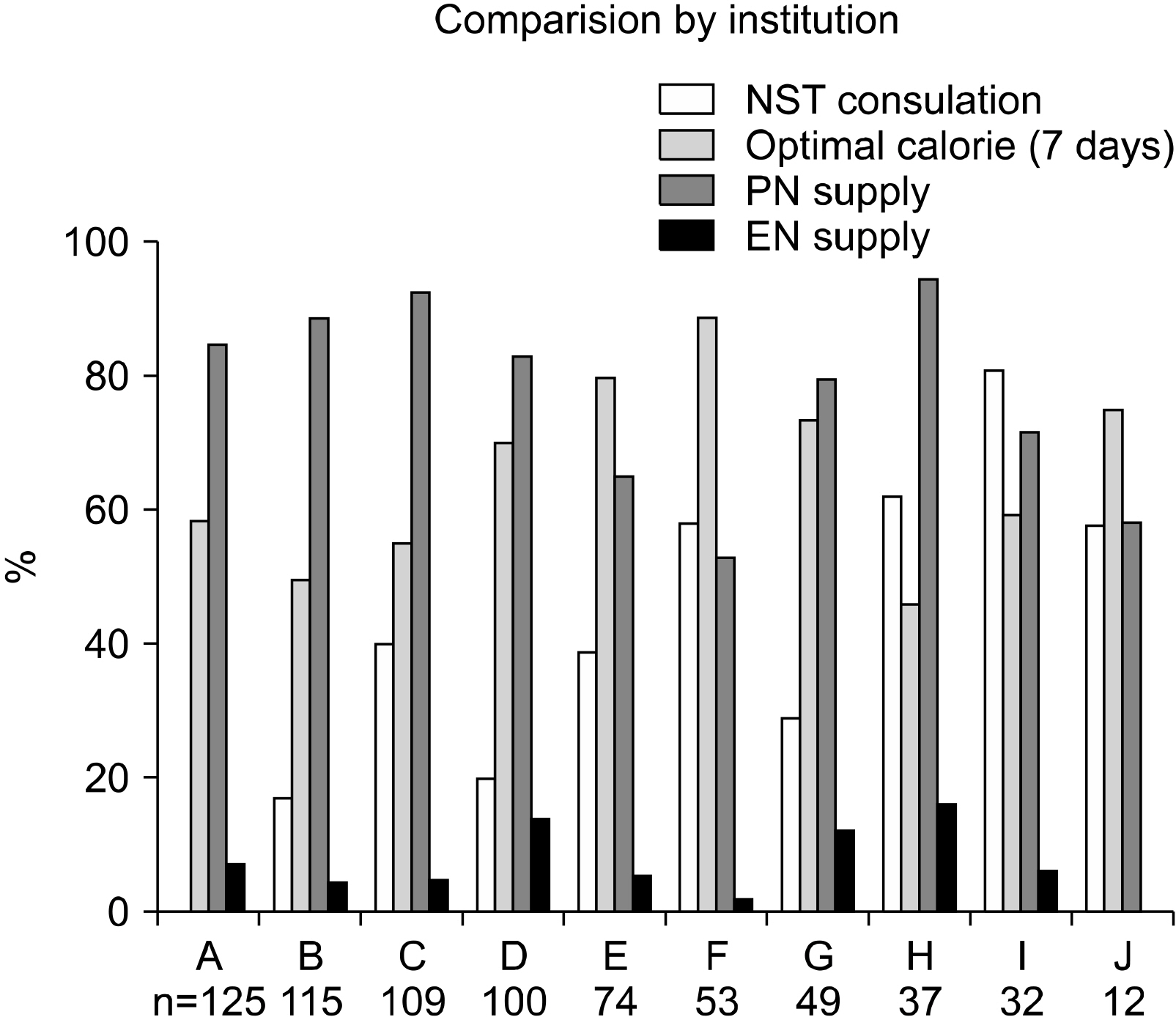
Fig. 1
Baseline characteristics
| Total (n=706) | Non-trauma (n=519) | Trauma (n=187) | P value | |
|---|---|---|---|---|
| Male | 448 (63.5%) | 299 (57.6%) | 149 (79.7%) | <0.001 |
| Age | 61.1±17.1 | 63.8±16.5 | 53.5±16.5 | <0.001 |
| Underlying disease | ||||
| HTN | 254 (36%) | 198 (38.2%) | 56 (29.9%) | 0.045 |
| DM | 116 (16.4%) | 89 (17.1%) | 27 (14.4%) | 0.391 |
| CKD | 26 (3.7%) | 26 (5.0%) | 0 | 0.002 |
| Cancer | 118 (16.7%) | 112 (21.6%) | 6 (3.2%) | <0.001 |
| LC | 13 (1.8%) | 11 (2.1%) | 2 (1.1%) | 0.360 |
| Height | 164.0±9.2 | 162.7±9.4 | 167.5±7.8 | <0.001 |
| Weight | 61.0±132.7 | 58.9±12.1 | 66.7±12.5 | <0.001 |
| BMI | 22.6±3.7 | 22.2±3.8 | 23.7±3.4 | <0.001 |
| Target calorie | 1,524±317 | 1,473±303 | 1,667±313 | <0.001 |
| Optimal calorie | 1,219±254 | 1,178±242 | 1,334±250 | <0.001 |
| NST consultation | 214 (30.3%) | 130 (25.0%) | 84 (44.9%) | <0.001 |
| Overall mortality | 73 (10.3%) | 54 (10.4%) | 19 (10.2%) | 0.925 |
Operation related data
| Total (n=706) | Non-trauma (n=519) | Trauma (n=187) | P value | |
|---|---|---|---|---|
| History of previous operation | 67 (9.5%) | 61 (11.8%) | 6 (3.2%) | <0.001 |
| Mini-invasive operation | 73 (10.3%) | 55 (10.6%) | 18 (9.6%) | 0.708 |
| Primary repair | 243 (34.4%) | 149 (28.7%) | 94 (50.3%) | <0.001 |
| Bowel resection | 418 (59.2%) | 325 (62.6%) | 93 (49.7%) | 0.002 |
| Operated organ | ||||
| Stomach | 104 (14.7%) | 96 (18.5%) | 8 (4.3%) | <0.001 |
| Duodenum | 52 (7.4%) | 47 (9.1%) | 5 (2.7%) | 0.004 |
| Small intestine | 356 (50.4%) | 232 (44.7%) | 124 (66.3%) | <0.001 |
| Colon | 223 (31.6%) | 183 (35.3%) | 40 (21.4%) | <0.001 |
| Mesentery | 57 (8.1%) | 0 | 27 (30.5%) | <0.001 |
| Stomy creation | 115 (16.3%) | 104 (20.1%) | 11 (5.9%) | <0.001 |
| Ileostomy | 46 (6.5%) | 43 (8.3%) | 3 (1.6%) | |
| Colostomy | 69 (9.8%) | 61 (11.8%) | 8 (4.3%) |
Type of nutritional support
| Total (n=706) | Non-trauma (n=519) | Trauma (n=187) | P value | |
|---|---|---|---|---|
| Operation to EN (days) | 12.1±8.9 | 11.7±7.3 | 12.9±11.6 | 0.638 |
| Operation to PN (days) | 2.6±3.2 | 2.3±3.2 | 3.6±2.8 | <0.001 |
| Operation to oral intake (days) | 10.7±9.6 | 10.5±8.9 | 11.3±11.6 | 0.387 |
| Duration of PN (days) | 9.1±9.2 | 9.2±8.6 | 8.7±10.9 | 0.611 |
| NST consultation (n, %) | 214 (30.3%) | 130 (25.0%) | 84 (44.9%) | <0.001 |
| Operation to NST (days) | 3.0±6.0 | 2.9±6.6 | 3.1±5.2 | 0.757 |
| Achieving optimal nutrition (n, %) | 659 (93.3%) | 488 (94.0%) | 171 (91.4%) | 0.224 |
| Operation to optimal (days) | 7.7±8.2 | 7.6±7.8 | 7.9±9.3 | 0.611 |
| Achieving optimal within 7 days (n, %) | 447 (63.3%) | 332 (64.0%) | 115 (61.5%) | 0.548 |
Nutritional parameter according to operation site and method
| Operation to oral intake (days) | P value | Operation to optimal (days) | P value | Optimal within 7 days (%) | P value | |
|---|---|---|---|---|---|---|
| Operated organ | ||||||
| Stomach | 10.3±8.9 | 0.837 | 8.7±13.2 | 0.595 | 61.5% | 0.685 |
| Duodenum | 9.7±6.6 | 0.989 | 7.6±4.5 | 0.299 | 57.7% | 0.383 |
| Small intestine | 10.8±10.6 | 0.636 | 7.3±5.7 | 0.581 | 64.0% | 0.685 |
| Colon | 12.4±12.3 | 0.230 | 7.9±6.6 | 0.006 | 63.2% | 0.974 |
| Mesentery | 11.1±13.2 | 0.936 | 9.6±14.3 | 0.022 | 57.9% | 0.377 |
| Multi-bowel injury | 16.0±18.6 | 0.045 | 9.0±8.2 | 0.227 | 61.7% | 0.782 |
| Operation type | 0.724 | |||||
| Primary repair | 9.8±9.7 | 0.242 | 7.6±8.4. | 0.648 | 64.2% | |
| Bowel resection | 11.8±10.9 | 0.571 | 8.1±8.7 | 0.229 | 62.4% | |
| Stomy creation | 13.5±11.7 | 8.7±7.0 | 60% | |||
| Mini-invasive op | <0.001 | <0.001 | <0.001 | |||
| Yes | 6.7±3.6 | 5.2±2.2 | 86.3% | |||
| No | 11.1±9.9 | 8.0±8.6 | 60.7% |

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

