Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > J Clin Nutr > Volume 8(1); 2016 > Article
- Original Article Effect of Fish Oil-based Intravenous Fat Emulsion with Parenteral Nutrition in Patients Undergoing Allogeneic Hematopoietic Stem Cell Transplantation
- Ji Hyeong Choe1, Young Joo Lee1, Hye Jung Bae1, Sun Hoi Jung1, Hyeon Joo Hahn1, Yungil Koh2
- 동종 조혈모세포이식을 받은 환자군에서의 Fish Oil을 함유하는 정맥지방유제 공급의 효과
- 최지형1, 이영주1, 배혜정1, 정선회1, 한현주1, 고영일2
-
Journal of the Korean Society for Parenteral and Enteral Nutrition 2016;8(1):29-35.
DOI: https://doi.org/10.15747/jcn.2016.8.1.29
Published online: April 30, 2016
Department of Pharmacy, Seoul National University Hospital, Seoul, Korea
Division of Hematology and Medical Oncology, Department of Internal Medicine, Seoul National University Hospital, Seoul, Korea
- Correspondence to Yungil Koh Division of Hematology and Medical Oncology, Department of Internal Medicine, Seoul National University Hospital, 101 Daehak-ro, Jongno-gu, Seoul 03080, Korea Tel: +82-2-2072-2114, Fax: +82-2-2072-7379, E-mail: youngilerica@gmail.com
- Sun Hoi Jung Department of Pharmacy, Seoul National University Hospital, 101 Daehak-ro, Jongno-gu, Seoul 03080, Korea Tel: +82-2-2072-3123, Fax: +82-2-766-1443, E-mail: shoijung@snuh.org
Copyright: © Korean Society for Parenteral and Enteral Nutrition
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 721 Views
- 2 Download
Abstract
-
Purpose: Omega-3 fatty acid is known for immunonutrition in that it has anti-inflammatory properties and improves the patients’ immune function. The objective of this study was to determine the effects of a fish oil-based lipid emulsion for adult patients undergoing allogeneic hematopoietic stem cell transplantation (HSCT).
-
Methods: This was a retrospective study of 90 adult allogeneic HSCT patients from July 2011 to June 2015. The patients were divided into two groups according to the lipid type provided; fish oil group (FO group, n=55) and non-fish oil group (NFO group, n=35). The demographics, parenteral nutrition and lipid emulsion duration, length of hospital stay (LOS), weight change, 30 day mortality, survival period, incidence of acute graft-versus-host disease (aGVHD), neutropenic fever, sepsis, and re-hospitalization were collected from the electronic medical records.
-
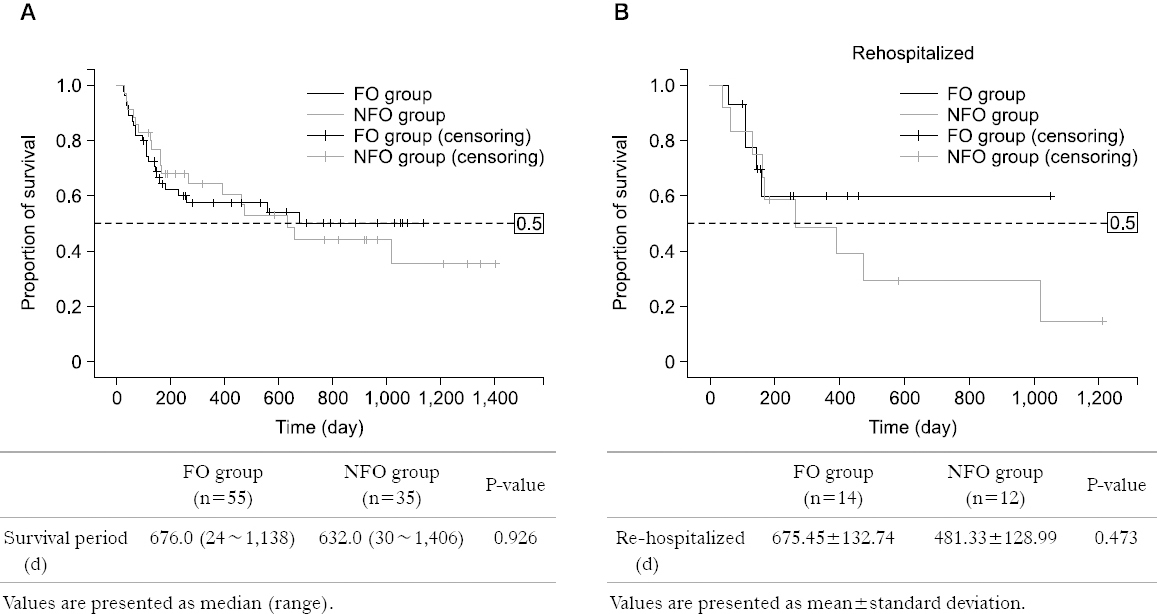
Results: The patients’ characteristics including age, sex, body mass index, and underlying disease were similar in the two groups. The incidence of aGVHD and infectious complications, mortality, LOS, re-hospitalization were also similar. The FO group showed weight gains, whereas the NFO group showed weight loss (FO vs. NFO=0.34% vs. −1.08%, P=0.245).
-
Conclusion: The clinical outcomes were similar in the two groups but there was a tendency for gain weight in the FO group. A large, well designed study, and a dosing study will also be needed to determine the optimal dose range for HSCT patients.
서론
대상 및 방법
결과
| Volume (mL) | Omega-3 triglyceride (g) | |
|---|---|---|
| Smoflipid 20%a | 100 | 3.00 |
| Smof Kabiven centrala | 1,477 | 8.43 |
| Smof Kabiven peripherala | 1,206 | 5.10 |
| Winuf centralb | 1,820 | 13.84 |
| Winuf peripheralb | 1,085 | 6.12 |
| Fish oil group (n=55) | Non-fish oil group (n=35) | P-value | |
|---|---|---|---|
| Weight change (%) | +0.34±5.61 | −1.08±5.57 | 0.245 |
고찰
결론
- 1. Charuhas PM, Lipkin A, Lenssen P, McMillen K. In: Merritt R, editor. Hematopoietic stem cell transplantation. A.S.P.E.N Nutrition support practice manual. 2nd ed. Silver Spring: ASPEN; 2005. p. 187-99.Article
- 2. August DA, Huhmann MB. American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. clinical guidelines:nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation. JPEN J Parenter Enteral Nutr 2009;33(5):472-500. ArticlePubMed
- 3. Bozzetti F, Arends J, Lundholm K, Micklewright A, Zurcher G, Muscaritoli M. ESPEN. ESPEN Guidelines on Parenteral Nutrition:non-surgical oncology. Clin Nutr 2009;28(4):445-54. ArticlePubMed
- 4. Vanek VW, Seidner DL, Allen P, Bistrian B, Collier S, Gura K, et al. Novel Nutrient Task Force Intravenous Fat Emulsions Workgroup;American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. position paper:clinical role for alternative intravenous fat emulsions. Nutr Clin Pract 2012;27(2):150-92. ArticlePubMed
- 5. Calder PC. Immunonutrition in surgical and critically ill patients. Br J Nutr 2007;98(Suppl 1):S133-9. ArticlePubMed
- 6. Ahn HS, Heo SC. Immunonutrition in surgical patients. JKSPEN 2013;5(1):10-4. Article
- 7. Marian M, Carlson SJ. Enteral formulations. In: The A.S.P.E.N nutrition support practice manual. 2nd ed. Silver Spring: ASPEN; 2005. p. 63-75.Article
- 8. van der Meij BS, van Bokhorst-de van der Schueren MA, Langius JA, Brouwer IA, van Leeuwen PA. n-3 PUFAs in cancer, surgery, and critical care:a systematic review on clinical effects, incorporation, and washout of oral or enteral compared with parenteral supplementation. Am J Clin Nutr 2011;94(5):1248-65. ArticlePubMed
- 9. Manzanares W, Langlois PL, Lemieux M, Heyland DK. Fish oil-containing emulsions:when fat seems to improve clinical outcomes in the critically ill. JPEN J Parenter Enteral Nutr 2016;40(3):305-7. ArticlePubMed
- 10. Takatsuka H, Takemoto Y, Iwata N, Suehiro A, Hamano T, Okamoto T, et al. Oral eicosapentaenoic acid for complications of bone marrow transplantation. Bone Marrow Transplant 2001;28(8):769-74. ArticlePubMedPDF
- 11. Socié G, Blazar BR. Acute graft-versus-host disease:from the bench to the bedside. Blood 2009;114(20):4327-36. ArticlePubMedPMCPDF
- 12. Filipovich AH, Weisdorf D, Pavletic S, Socie G, Wingard JR, Lee SJ, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease:I. diagnosis and staging working group report. Biol Blood Marrow Transplant 2005;11(12):945-56. ArticlePubMed
- 13. Jho DH, Cole SM, Lee EM, Espat NJ. Role of omega-3 fatty acid supplementation in inflammation and malignancy. Integr Cancer Ther 2004;3(2):98-111. ArticlePubMedPDF
- 14. Pradelli L, Mayer K, Muscaritoli M, Heller AR. n-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients:a meta-analysis. Crit Care 2012;16(5):R184.ArticlePubMedPMCPDF
- 15. Palmer AJ, Ho CK, Ajibola O, Avenell A. The role of ω-3 fatty acid supplemented parenteral nutrition in critical illness in adults:a systematic review and meta-analysis. Crit Care Med 2013;41(1):307-16. ArticlePubMed
- 16. Li NN, Zhou Y, Qin XP, Chen Y, He D, Feng JY, et al. Does intravenous fish oil benefit patients post-surgery? A meta- analysis of randomised controlled trials. Clin Nutr 2014;33(2):226-39. ArticlePubMed
- 17. Wei C, Hua J, Bin C, Klassen K. Impact of lipid emulsion containing fish oil on outcomes of surgical patients:systematic review of randomized controlled trials from Europe and Asia. Nutrition 2010;26(5):474-81. ArticlePubMed
- 18. Chen B, Zhou Y, Yang P, Wan HW, Wu XT. Safety and efficacy of fish oil-enriched parenteral nutrition regimen on postoperative patients undergoing major abdominal surgery:a meta-analysis of randomized controlled trials. JPEN J Parenter Enteral Nutr 2010;34(4):387-94. ArticlePubMed
- 19. Takatsuka H, Iwasaki T, Okamoto T, Kakishita E. Intestinal graft-versus-host disease:mechanisms and management. Drugs 2003;63(1):1-15. Article
- 20. Aoyagi T, Terracina KP, Raza A, Matsubara H, Takabe K. Cancer cachexia, mechanism and treatment. World J Gastrointest Oncol 2015;7(4):17-29. ArticlePubMedPMC
- 21. Tisdale MJ. Mechanisms of cancer cachexia. Physiol Rev 2009;89(2):381-410. ArticlePubMed
- 22. Rzepecki P, Barzal J, Oborska S. Blood and marrow transplantation and nutritional support. Support Care Cancer 2010;18(Suppl 2):S57-65. ArticlePubMedPDF
- 23. Heller AR, Rössler S, Litz RJ, Stehr SN, Heller SC, Koch R, et al. Omega-3 fatty acids improve the diagnosis-related clinical outcome. Crit Care Med 2006;34(4):972-9. ArticlePubMed
- 24. Heller AR. Intravenous fish oil in adult intensive care unit patients. World Rev Nutr Diet 2015;112:127-40. ArticlePubMed
- 25. Sacks GS, Mayhew S, Johnson D. Parenteral nutrition implementation and management. A.S.P.E.N Nutrition support practice manual. 2005. 2nd ed. Silver Spring: ASPEN; p. 108-17.Article
References
Figure & Data
REFERENCES
Citations

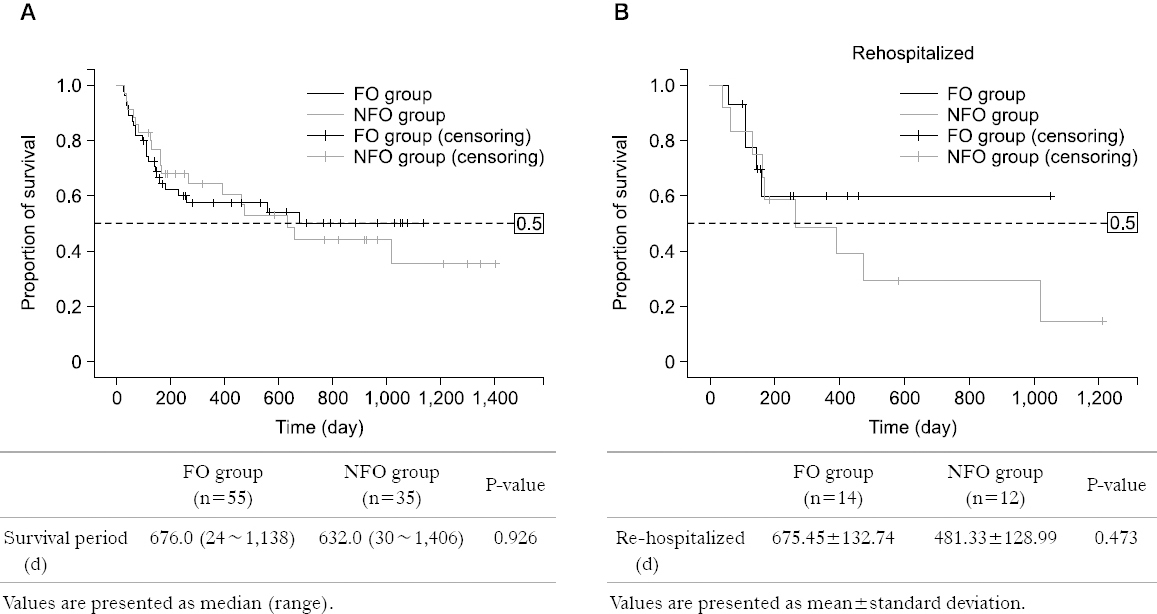
Fig. 1
Patients’ characteristics (n=90)
| Characteristic | Fish oil group (n=55) | Non-fish oil group (n=35) | P-value |
|---|---|---|---|
| Age (y) | 46 (21~64) | 42 (22~62) | 0.266 |
| Sex (male/female) | 34/21 (61.8/38.2) | 22/13 (62.9/37.1) | 0.921 |
| Height (cm) | 165.59±8.08 | 168.96±7.10 | 0.046 |
| Weight (kg) | 62.71±12.98 | 67.56±12.88 | 0.087 |
| Body mass index (kg/m2) | 22.80±4.10 | 23.51±3.29 | 0.390 |
| Disease | 0.125 | ||
| Acute lymphocytic leukemia | 12 (21.8) | 15 (42.9) | |
| Acute myeloblastic leukemia | 31 (56.4) | 14 (40.0) | |
| Hodgkin lymphoma | 1 (1.8) | 2 (5.7) | |
| Myelo-dysplastic syndrome | 8 (14.5) | 2 (5.7) | |
| Severe aplastic anemia | 3 (5.5) | 2 (5.7) | |
| Transplantation source | 0.389 | ||
| Peripheral blood | 55 (100.0) | 34 (97.1) | |
| Bone marrow | 0 | 1 (2.9) | |
| Donor HLA typing | 0.191 | ||
| Full match | 38 (69.1) | 20 (57.1) | |
| 1 locus mismatch | 13 (23.6) | 8 (22.9) | |
| 2 loci mismatch | 4 (7.3) | 7 (20.0) | |
| Disease status (n=75) | 0.171 | ||
| CR1 | 26 (59.1) | 21 (67.7) | |
| CR2 | 9 (20.5) | 5 (16.1) | |
| Partial remission | 0 | 2 (6.5) | |
| Persist | 8 (18.2) | 2 (6.5) | |
| Progressive disease | 0 | 1 (3.2) | |
| Relapse | 1 (2.3) | 0 | |
Values are presented as median (range), number (%), or mean±standard deviation.
CR = complete remission.
Content of omega-3 triglyceride (n=55)
| Volume (mL) | Omega-3 triglyceride (g) | |
|---|---|---|
| Smoflipid 20% |
100 | 3.00 |
| Smof Kabiven central |
1,477 | 8.43 |
| Smof Kabiven peripheral |
1,206 | 5.10 |
| Winuf central |
1,820 | 13.84 |
| Winuf peripheral |
1,085 | 6.12 |
aFresenius Kabi, Frankfurt,
bJW Pharma, Seoul, Korea
Nutrition support state (n=90)
| Fish oil group (n=55) | Non-fish oil group (n=35) | P-value | |
|---|---|---|---|
| Total parenteral nutrition duration (d) | 23 (3~144) | 17 (3~68) | 0.010 |
| Lipid duration (d) | 14 (3~95) | 14 (3~46) | 0.587 |
| Lipid dose (g/kg) | 0.218~1.193 | 0.364~1.451 | - |
| ω-3 dose (g/kg) (n=55) | 0.033~0.240 | 0 | - |
Values are presented as median (range) or range only.
Clinical outcomes (n=90)
| Fish oil group (n=55) | Non-fish oil group (n=35) | P-value | |
|---|---|---|---|
| Acute graft-versus-host disease | 26 (47.3) | 19 (54.3) | 0.517 |
| Neutropenic fever | 35 (63.6) | 23 (65.7) | 0.841 |
| Sepsis (culture) | 22 (40.0) | 9 (25.7) | 0.164 |
| 30 days mortality | 2 (3.6) | 1 (2.9) | 1.000 |
| Length of stay | 44 (24~323) | 43 (23~107) | 0.474 |
| Rehaspitalization (n=71) | 14/40 (35.0) | 12/31 (38.7) | 0.748 |
Values are presented as number (%) or median (range).
Weight change (n=90)
| Fish oil group (n=55) | Non-fish oil group (n=35) | P-value | |
|---|---|---|---|
| Weight change (%) | +0.34±5.61 | −1.08±5.57 | 0.245 |
Values are presented as mean±standard deviation.
Values are presented as median (range), number (%), or mean±standard deviation. CR = complete remission.
Fresenius Kabi, Frankfurt, JW Pharma, Seoul, Korea
Values are presented as median (range) or range only.
Values are presented as number (%) or median (range).
Values are presented as mean±standard deviation.

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN Cite
Cite

