Indexed in:
Scopus, KCI, KoreaMed
Scopus, KCI, KoreaMed

Articles
- Page Path
- HOME > Surgical Metabolism and Nutrition > Volume 8(2); 2017 > Article
- Review Article Nutritional Support for Patients with Postoperative Pancreatic Fistula, or Pancreatitis
- In Woong Han, M.D., Ph.D.
- 수술 후 췌장루 및 췌장염 환자의 영양공급
- 한인 웅, M.D., Ph.D.
-
Surgical Metabolism and Nutrition 2017;8(2):23-27.
DOI: https://doi.org/10.18858/smn.2017.8.2.23
Published online: December 30, 2017
Division of Hepato-biliary and Pancreatic Surgery, Department of Surgery, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea
- Correspondence to: In Woong Han, Division of Hepato-biliary and Pancreatic Surgery, Department of Surgery, Samsung Medical Center, Sungkyunkwan University School of Medicine, 81 Irwon-ro, Gangnam-gu, Seoul 06351, Korea Tel: +82-2-3410-0772, Fax: +82-2-3410-6980, E-mail: cardioman76@gmail.com
This article was presented at 23th conference of KSSMN.
• Received: December 11, 2017 • Accepted: December 18, 2017
Copyright: © The Korean Society of Surgical Metabolism and Nutrition
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 935 Views
- 10 Download
Abstract
- In terms of nutritional therapy after pancreatectomy, there is no need for routine use of artificial nutrition supplementation except in the case of malnutrition or complications. Postoperative pancreatic fistula (POPF) is one of the most representative complications of pancreatectomy, and adequate nutritional support is important for management of POPF. Oral diet or enteral nutrition (EN) treatment is preferred over parenteral nutrition (PN) since oral diet or EN results in higher POPF closure rates and lower complication rates than EN. Postoperative pancreatitis is usually managed according to the general principle of acute pancreatitis. There is no need to provide specialized nutrition therapy for mild pancreatitis, whereas moderate-to severe pancreatitis should be treated with early specialized nutritional therapy. EN is a more preferred nutritional supplement method over PN due to its lower complication rate, shorter hospital stay, less frequent multi-organ failure, and mortality. Long-term sequelae after POPF or pancreatitis include exocrine or endocrine insufficiency. In the case of exocrine insufficiency, exocrine replacement therapy should be administered. Moreover, endocrine insufficiency, commonly represented by diabetes mellitus (DM), should be managed based on guidelines for type 1 or 2 DM.
서론
췌십이지장절제술(Pancreatoduodenectomy; PD) 또는 유문보존췌십이지장절제술(pylorus-preserving PD; PPPD)는 다양한 유두부 주위 종양(periampullary tumor)의 표준적인 술기이다. 원위부 췌절제술은 췌장의 몸통 및 꼬리에 발생하는 질환에 대한 대표적인 술기이며, 이는 비장 또는 비장혈관을 보존하는 술식, 복강동맥을 합병절제하는 술식(distal pancreatectomy with celiac axis resection; DP-CAR), 근치적 전향적 췌미부-비장절제술(Radical Antegrade Modular PancreatoSplenectomy; RAMPS) 등의 다양한 변형술식이 임상에 적용되어 왔다.[1-4]
최근 수술 술기 및 수술 전후 관리의 발달로 인해, 수술 경험이 많은 기관의 경우 수술 후 사망률은 1∼5%로 상당히 감소하였다.[5] 그러나 수술 전 환자들의 영양상태가 불량한 경우가 많고, 수술적 절제 범위가 타 수술에 비해서 광범위해 수술 후 합병증률은 현재에도 40∼60%에 이르고 있다.[6]
췌절제술후 가장 대표적인 합병증은 위배출지연, 수술 후 췌장루, 수술 후 췌장염 등이 있다. 그 중에서도 수술 후 췌장루 및 췌장염은 췌십이지장절제술과 원위부 췌절제술의 공통적인 합병증으로, 그 치료법 및 영양공급법에 대해서 아직 자세하게 정립되어 있지 않다. 따라서 이 종설에서는 췌절제술 후 발생할 수 있는 수술 후 췌장루와 췌장염에서의 적절한 영양공급에 대해서 논하고자 한다.
본론
2012년 출판된 ERAS guideline에 따르면, 췌십이지장절제술 전후의 일반적인 영양공급은 Table 1과 같다. 심각한 영양결핍이 있는 환자를 제외하면, 대부분의 경우 수술 전 추가적인 영양공급은 불필요하다. 수술 전후 면역영양(Immuno-nutrition)은 도움이 된다고 알려져 있으며, 수술 후 경구 영양이 가능한 환자는 별도의 추가 영양공급은 필요하지 않다(Table 1).[7]
Table 1
Nutritional supplement after pancreatectomy. ERAS guideline, 2012 [7]
ASPEN [8] 및 ESPEN [9]에서는 일반적인 복부 수술에 대한 영양공급에 대한 지침은 제시하고 있으나, 췌절제술에 대한 특이적 영양공급에 대한 지침은 현재까지 마련되어 있지 않다. 다만, 최근 출판된 ASPEN guideline [10]에서는 수술 후 발생한 췌장염에 대한 치료법에 대해 제시하고 있으며, 이것은 본 종설의 후반부에 다루기로 한다.
수술후 췌장루는 International Study Group of Pancreatic Fistula (ISGPF)의 정의를 가장 많이 사용하고 있다. 2016년에 개정된 ISGPF에 따르면, 수술 후 췌장루는 “췌장관 상피와 다른 상피간의 교통에 따른 췌장효소가 풍부한 췌장액의 저류”로 정의한다.[11,12]
수술 후 췌장루의 예방에 대해서는 그간 많은 연구가 이루어져 왔다. 췌장-공장 또는 췌장-위문합법, 스텐트 사용 유무, 췌장 절단 방법 등의 수술 술기에 대한 연구, 특정 약물의 효과, 수술 전 환자의 인구학적 특징 등에 대해 다양한 연구가 시도되었으나, 아직 획기적인 예방법은 알려져 있지 않다.[12-15]
또한 췌장루 치료에 대한 일치된 견해도 아직 마련되어 있지 않다. 최근 연구에 따르면,[16] 일차적 치료는 경구 영양섭취 제한, 소마토스타틴 등의 췌장분비 억제제 사용, 적절한 영양공급, 필요시 항생제 투여 등이다. 환자 상태가 급격히 악화되는 경우 췌장 저류액을 배액하고, 재수술까지도 고려할 수 있다.
적절한 영양공급은 췌장루 환자 치료의 핵심적인 요소중의 하나이다. 수술 후 부적절한 영양공급으로 인한 영양불량은, 소위 high-output 췌장루의 위험인자이다.[12] 전통적으로, 췌장루는 그 병태생리학적 특징, 즉 경구섭취를 줄이면 췌액의 분비가 줄어 췌장루 호전에 도움이 될 거라는 인식에 기반하여 경구 영양섭취를 제한해 왔다.[12] 또한 현재 개발된 인공영양 (Artificial nutrition)의 발전에 힘입어, 경구 영양 금지에 대한 인식을 공고히 할 수 있었다.[12]
그러나 잘 알려진 바와 같이, 경구 및 경관영양(Enteral nutrition)은 정맥 영양(Parenreral nutrition)에 비해 위장관 점막을 보호하고, 장관내 박테리아 생태계를 보존할 수 있는 등의 장점이 있다.[17] 또한 한 전향적 무작위배정연구는 췌장루 환자에서 경장영양을 공급했을 때 정맥영양에 비해 빠른 췌장루 회복률, 빠른 회복시간을 보임을 보고하였다.[17] 또한 2015년 발표된 다기관 전향적 연구에서도 경구영양을 시행했을 때 췌장루 악화률과 배액관 거치 기간이 금식군과 비교하여 차이가 없음을 보고한 바 있어 췌장루에서 금식이 반드시 필요한 치료가 아님을 입증하였다.[18]
급성 췌장염의 전형적인 병태생리는, 췌관 선포세포(acinar cell)에서 트립신(trypsin)의 조절되지 않는 활성화가 그 중심이다.[19] 원인으로는 췌관 폐쇄, 약물, 수술, 유전적 인자로 다양하며, 검사실 소견은 특징적으로 혈정 아밀라아제 및 리파아제의 증가 및 칼슘의 감소 등이 있다.[19] 전형적인 영상 소견은 Fig. 1과 같다(Fig. 1). 이중 수술로 인해 발생하는 췌장염의 원인은 잘 알려져 있지 않다. 그러나 임상적으로 문제가 될 만큼 악화하는 소견은 흔하지 않으며, 대부분 단백효소 저해제 (protease inhibitor)나 소마토스타틴 같은 췌액 분비 억제제에 반응이 좋은 것으로 알려져 있다.[19] 따라서 급성기 치료에 대한 가이드라인은 통상적인 급성췌장염의 그것과 다르지 않다. 수술 후 췌장염의 임상경과를 고려할 때 급성기의 치료보다는 만성 후유증(sequalae)이 더 중요하다.
전술한 바와 같이 수술 후 췌장염의 급성기 치료에 대한 지침은 현재까지 발표되지 않아, 급성췌장염의 영양공급으로 갈음해도 충분하다. 가장 대표적으로 사용되는 급성췌장염의 영양공급은 ASPEN guideline이다.[20] 이에 따르면, 급성 췌장염의 영양공급을 위해서는 병의 중증도를 자주 측정하고, 경구 및 경장영양의 가능성을 지속적으로 파악할 것을 권고한다.
경증(mild)의 급성췌장염에서는 정맥영양을 포함한 별도의 특별한 영양공급은 필요하지 않으나, 합병증이 동반되었거나 7일 이상의 금식을 요할 경우 정맥영양을 고려해야 한다. 중등도(moderate) 이상의 췌장염에서는 영양공급이 중요한 치료 항목으로 격상된다. 환자의 임상상 악화로 인해 경구 영양이 불가능한 경우가 많으므로, 입원 후 24∼48시간 이내에 비위관(naso-gastric tube) 또는 비장관(naso-enteric tube)을 통한 경장영액을 시작해야 한다. 이에 도움이 되는 특별한 경장영양제제는 알려진 바가 없고, 면역영양은 시도해 볼 수는 있으나 아직 그 근거가 충분하지 않다.[20] 영양공급방법으로는 정맥영양보다는 경장영양이 선호되며, 이는 경장영양에서 감염 및 재원기간, 수술적 치료의 필요성, 다기관부전, 사망률 등의 대부분의 지표에서 정맥영양에 비해 우월한 것으로 보고되기 때문이다. 경장영양의 공급방법으로는 비위관과 비장관을 이용하는 방법이 있으며, 둘 간의 우위는 분명하지 않다.[20] 활생균 (probiotics)의 투여는 고려해 볼 수 있으나 그 임상적 근거는 아직 적고, 췌장염 발병 후 1주 이상 경장영양이 불가능한 경우 정맥영양을 투여해야 한다.[21,22]
2013년 국내 연구진들에 의해, 췌장절제술 후 환자들의 회복기간은 6개월에 달한다는 보고가 발표되었다.[23] 이에 따르면, 환자들 중 특히 60세 이상의 고령, 췌십이지장절제술, 만성 췌장염 합병여부, 악성 질환을 가진 경우 주의 깊은 추적 관찰 및 보존적 치료가 요구된다.[23] 통상적인 췌절제술에서 양성 질환의 경우 술 후 2∼3개월이면 정상체중을 회복하고, 6개월 정도면 술 전 체중을 회복한다고 알려져 있다.[23] 그러나 악성 질환의 경우 항암 방사선 치료 등의 시행 여부에 따라 회복 기간이 상대적으로 더 필요하다.[23]
급성기 경과후의 만성 경과에서 보일 수 있는 기능적 문제들은 악액질(Cachexia), 내분비 및 외분비 기능 장애가 있다. 악액질은 대부분 원발 질환의 재발과 관련이 있어 본 종설에서는 다루지 않기로 한다. 내분비 및 외분비 기능의 장애는 앞서 살펴본 췌장루 및 췌장염이 대표적인 원인이다. 췌장루 및 췌장염으로 인한 췌실질의 위축(atrophy) 및 췌관의 확대가 췌장 기능의 상실을 불러오기 때문이다.[24,25] 최근 발표된 메타분석은 19개의 기존 연구 총 1,295명의 환자를 대상으로 연구한 결과, 췌절제술 자체가 새로이 발생한 당뇨의 유의미한 증가 및 외분비 기능을 상실을 일으킴을 보고하였다.[26]
췌절제술을 요하는 양성 및 악성 종양 환자들은 대부분 진단 당시 또는 수술 이후 외분비 기능 장애를 겪을 수 있다.[27] 외분비 기능 장애를 진단받은 환자들은 췌장효소보충치료(Pancreatic exocrine replacement treatment; PERT)를 시행받을 필요가 있으며, 이의 구체적인 방법은 최근 발표된 호주 그룹의 기준에 따르면 Table 2와 같다.[28]
Table 2
PERT recommendation from Australia study group [28]
흥미로운 사실은, 이러한 췌장효소보충치료는 외분비 기능의 회복뿐만 아니라, 팽대부 주위 종양으로 췌십이지장 절제술을 시행받은 환자에게서 생존률을 개선시키는 효과가 있다는 보고도 있다.[29] 상기 연구진들은 2007년부터 2015년까지 469명의 환자를 대상으로 후향적 연구를 시행한 결과 PERT 시행군에서 대조군에 비해 생존에 미치는 위험률(hazard ratio)이 다변량 분석 후 0.75 (95% confidence interval 0.57∼0.99, P=0.046)으로 보고하였다.[29]
실제 PERT를 시행하는 방법은, 권고안마다 약간의 차이는 있으나, 다음과 같다.[30] 반응이 있을 때까지 투여량을 점진적으로 증가시키고, 환자의 복약 순응도를 확인한다. 약물의 효과를 위해 제산제를 병합 투여하고, 식후 뿐만 아니라 식간 투여도 진행한다. 위 내에서 불활성화를 고려하여 미세구체 (microspheres)를 사용하며, 위장관내의 내재적 문제가 병합되어 있는지 확인한다.[30]
수술 후 췌장루 및 췌장염으로 인해 발생하는 당뇨는, type 3c로 분류되는 수술 후 당뇨에 해당된다.[31-33] 실제로 췌절제술 후 발생하는 당뇨의 빈도는 대략 5∼40%이며, 이의 위험 인자로는 인종, 기저질환, 수술 후 합병증 유무, 췌장염 동반 유무, 절제된 췌장의 양, 추적 관찰 기간 등이다.[31-33] 원위부 췌절제술이 췌십이지장 절제술보다 당뇨의 위험성이 더 크다는 사실은 잘 알려져 있으며, 국내의 한 연구진은 술전 당뇨가 있었던 40%의 환자가 췌십이지장절제술 후 오히려 당뇨가 개선되었다는 사실을 보고하였다. 이는 췌절제술이 당내증 (insulin resistance)을 개선시켜 당 촉진 인슐린 분비(glucose stimulated insulin secretion)를 강화하는 것으로 해석하였다. [34]
수술 후 당뇨는 기존의 제 1형 및 제 2형 당뇨와 혈관 합병증 발생 위험성이 비슷한 것으로 알려져 있다.[35] 따라서 그 치료법은 제 1형 및 제 2형 당뇨의 치료에 준해서 진행된다. 특징적으로 type 3c 당뇨의 경우 인슐린과 글루카곤의 분비능이 모두 저해되어 있다. 목표 당화혈색소(HbA1c) 수치는 7% 미만이며, 평소 혈당치는 삶의 질 향상을 위해 정상치보다 약간 높게 유지하여도 무방하다. 통상적으로 경구 혈당강하제보다는 인슐린이 반응이 더 좋으며, 기저 췌장의 염증 완화를 위해 금주 및 금연이 반드시 필요하다. 외분비 동반 기능 장애가 흔하기 때문에, PERT를 적극적으로 고려해야 한다.[35]
결론
일반적으로, 합병증이나 심각한 영양결핍이 없는 췌절제술 환자에게 인공영양 공급은 필요하지 않다. 임상적으로 유의미한 수술 후 췌장루가 발생한 경우에는 적절한 영양공급이 필수불가결하며, 공급방법으로는 췌장루 소실 및 동반 합병증 발생 여부를 고려할 때 경구 또는 경장 영양이 정맥영양에 비해 선호된다. 수술 후 췌장염의 치료는 일반적인 급성췌장염의 치료에 준하며, 경중인 경우 특별한 영양공급이 중요하지 않지만 중등도 이상인 경우 적극적인 영양공급을 시행해야 하며, 이 경우에도 경구 및 경장영양을 정맥영양보다 먼저 고려해야 한다. 췌장루 및 췌장염의 만성 경과를 고려할 때 내분비 및 외분비 기능의 저하가 동반되는 경우가 흔하므로, 적극적인 혈당 관리 및 췌장효소 보충제 투여를 고려해야 한다.
- 1. Rutz DR, Squires MH, Maithel SK, Sarmiento JM, Etra JW, Perez SD, et al. Cost comparison analysis of open versus laparoscopic distal pancreatectomy. HPB (Oxford) 2014;16:907-14. ArticlePubMedPMC
- 2. Ome Y, Hashida K, Yokota M, Nagahisa Y, Michio O, Kawamoto K. Laparoscopic radical antegrade modular pancreatosplenectomy for left-sided pancreatic cancer using the ligament of Treitz approach. Surg Endosc 2017;31:4836-7. ArticlePubMedPDF
- 3. Drymousis P, Raptis DA, Spalding D, Fernandez-Cruz L, Menon D, Breitenstein S, et al. Laparoscopic versus open pancreas resection for pancreatic neuroendocrine tumours: a systematic review and meta-analysis. HPB (Oxford) 2014;16:397-406. ArticlePubMedPMC
- 4. Yamamoto T, Satoi S, Kawai M, Motoi F, Sho M, Uemura KI, et al. Is distal pancreatectomy with en-bloc celiac axis resection effective for patients with locally advanced pancreatic ductal adenocarcinoma?-Multicenter surgical group study. Pancreatology doi:10.1016/j.pan.2017.11.005. [In press]. Article
- 5. La Torre M, Ziparo V, Nigri G, Cavallini M, Balducci G, Ramacciato G. Malnutrition and pancreatic surgery: prevalence and outcomes. J Surg Oncol 2017;2013;107:702-8. ArticlePubMedPDF
- 6. Bozzetti F, Mariani L. Perioperative nutritional support of patients undergoing pancreatic surgery in the age of ERAS. Nutrition 2014;30:1267-71. ArticlePubMed
- 7. Lassen K, Coolsen MM, Slim K, Carli F, de Aguilar-Nascimento JE, Schäfer M, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr 2012;31:817-30. ArticlePubMed
- 8. Boullata JI, Carrera AL, Harvey L, Escuro AA, Hudson L, Mays A, et al. ASPEN safe practices for enteral nutrition therapy [Formula: see text]. JPEN J Parenter Enteral Nutr 2017;41:15-103. ArticlePubMed
- 9. Weimann A, Braga M, Carli F, Higashiguchi T, Hübner M, Klek S, et al. ESPEN guideline: clinical nutrition in surgery. Clin Nutr 2017;36:623-50. ArticlePubMed
- 10. McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016;40:159-211. ArticlePubMed
- 11. Bassi C, Marchegiani G, Dervenis C, Sarr M, Abu Hilal M, Adham M, et al. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula:11 Years After. Surgery 2017;161:584-91. ArticlePubMed
- 12. Bassi C, Dervenis C, Butturini G, Fingerhut A, Yeo C, Izbicki J, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138:8-13. ArticlePubMed
- 13. Wang C, Zhao X, You S. Efficacy of the prophylactic use of octreotide for the prevention of complications after pancreatic resection: an updated systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2017;96:e7500.ArticlePubMedPMC
- 14. Chang YR, Kang JS, Jang JY, Jung WH, Kang MJ, Lee KB, et al. Prediction of pancreatic fistula after distal pancreatectomy based on cross-sectional images. World J Surg 2017;41:1610-7. ArticlePubMedPDF
- 15. Han IW, Kim H, Heo J, Oh MG, Choi YS, Lee SE, et al. Excess intraoperative fluid volume administration is associated with pancreatic fistula after pancreaticoduodenectomy: a retrospective multicenter study. Medicine (Baltimore) 2017;96:e6893.ArticlePubMedPMC
- 16. Bressan AK, Wahba M, Dixon E, Ball CG. Completion pancreatectomy in the acute management of pancreatic fistula after pancreaticoduodenectomy: a systematic review and qualitative synthesis of the literature. HPB (Oxford) doi:10.1016/j.hpb.2017.08.036. [In press]. Article
- 17. Klek S, Sierzega M, Turczynowski L, Szybinski P, Szczepanek K, Kulig J. Enteral and parenteral nutrition in the conservative treatment of pancreatic fistula: a randomized clinical trial. Gastroenterology 2017;2011;141:157-63; 163e1.ArticlePubMed
- 18. Fujii T, Yamada S, Murotani K, Okamura Y, Ishigure K, Kanda M, et al. Oral food intake versus fasting on postoperative pancreatic fistula after distal pancreatectomy: a multi-institutional randomized controlled trial. Medicine (Baltimore) 2015;94:e2398.ArticlePubMedPMC
- 19. Frossard JL, Steer ML, Pastor CM. Acute pancreatitis. Lancet 2008;371:143-52. ArticlePubMed
- 20. McClave SA, Chang WK, Dhaliwal R, Heyland DK. Nutrition support in acute pancreatitis: a systematic review of the literature. JPEN J Parenter Enteral Nutr 2006;30:143-56. ArticlePubMedPDF
- 21. Marik PE, Zaloga GP. Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ 2004;328:1407.ArticlePubMedPMC
- 22. Cao Y, Xu Y, Lu T, Gao F, Mo Z. Meta-analysis of enteral nutrition versus total parenteral nutrition in patients with severe acute pancreatitis. Ann Nutr Metab 2008;53:268-75. ArticlePubMedPDF
- 23. Park JW, Jang JY, Kim EJ, Kang MJ, Kwon W, Chang YR, et al. Effects of pancreatectomy on nutritional state, pancreatic function and quality of life. Br J Surg 2013;100:1064-70. ArticlePubMedPDF
- 24. Fang WL, Su CH, Shyr YM, Chen TH, Lee RC, Tai LC, et al. Functional and morphological changes in pancreatic remnant after pancreaticoduodenectomy. Pancreas 2007;35:361-5. ArticlePubMed
- 25. Tomimaru Y, Takeda Y, Kobayashi S, Marubashi S, Lee CM, Tanemura M, et al. Comparison of postoperative morphological changes in remnant pancreas between pancreaticojejunostomy and pancreaticogastrostomy after pancreaticoduodenectomy. Pancreas 2009;38:203-7. ArticlePubMed
- 26. Beger HG, Poch B, Mayer B, Siech M. New onset of diabetes and pancreatic exocrine insufficiency after pancreaticoduodenectomy for benign and malignant tumors: a systematic review and meta-analysis of long-term results. Ann Surg doi:10.1097/SLA.0000000000002422. [In press]. Article
- 27. Sikkens EC, Cahen DL, de Wit J, Looman CW, van Eijck C, Bruno MJ. Prospective assessment of the influence of pancreatic cancer resection on exocrine pancreatic function. Br J Surg 2017;2014;101:109-13. ArticlePubMedPDF
- 28. Nikfarjam M, Wilson JS, Smith RC; Australasian Pancreatic Club Pancreatic Enzyme Replacement Therapy Guidelines Working Group. Diagnosis and management of pancreatic exocrine insufficiency. Med J Aust 2017;207:161-5. ArticlePubMedPDF
- 29. Roberts KJ, Schrem H, Hodson J, Angelico R, Dasari BVM, Coldham CA, et al. Pancreas exocrine replacement therapy is associated with increased survival following pancreatoduodenectomy for periampullary malignancy. HPB (Oxford) 2017;19:859-67. ArticlePubMed
- 30. Struyvenberg MR, Martin CR, Freedman SD. Practical guide to exocrine pancreatic insufficiency - Breaking the myths. BMC Med 2017;15:29.ArticlePubMedPMCPDF
- 31. Elliott IA, Epelboym I, Winner M, Allendorf JD, Haigh PI. Population-level incidence and predictors of surgically induced diabetes and exocrine insufficiency after partial pancreatic resection. Perm J 21.Article
- 32. Ito T, Otsuki M, Igarashi H, Kihara Y, Kawabe K, Nakamura T, et al. Epidemiological study of pancreatic diabetes in Japan in 2005: a nationwide study. Pancreas 2017;2010;39:829-35. ArticlePubMed
- 33. Maeda H, Hanazaki K. Pancreatogenic diabetes after pancreatic resection. Pancreatology 2011;11:268-76. ArticlePubMed
- 34. Kang MJ, Jung HS, Jang JY, Jung W, Chang J, Shin YC, et al. Metabolic effect of pancreatoduodenectomy: resolution of diabetes mellitus after surgery. Pancreatology 2016;16:272-7. ArticlePubMed
- 35. Makuc J. Management of pancreatogenic diabetes: challenges and solutions. Diabetes Metab Syndr Obes 2016;9:311-5. ArticlePubMedPMC
References
Figure & Data
REFERENCES
Citations
Citations to this article as recorded by 

Nutritional Support for Patients with Postoperative Pancreatic Fistula, or Pancreatitis
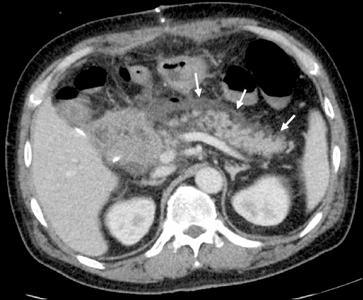
Fig. 1
Abdominal computed tomography in patients with postoperative pancreatitis.
Fig. 1
Nutritional Support for Patients with Postoperative Pancreatic Fistula, or Pancreatitis
Nutritional supplement after pancreatectomy. ERAS guideline, 2012 [7]
| Item | Summary and recommendations | Evidence level | Recommendation grade |
|---|---|---|---|
| Preoperative nutrition | Routine use of artificial nutrition: not warranted significantly malnourished patients: oral supplements or enteral nutrition preoperatively | Very low | Weak |
| Perioperative Immuno-nutrition (IN) | IN for 5∼7 days perioperatively should be considered because it may reduce the rate of infectious complications | Moderate | Weak |
| Postoperative artificial nutrition | Normal diet after surgery without restrictions. Enteral tube feeding: only on specific indications Parenteral nutrition: should not be used routinely | Early diet at will: moderate | Strong |
PERT recommendation from Australia study group [28]
| No | Recommendation |
|---|---|
| 1 | Any patient requiring pancreatic resection should be assessed for the presence of PEI postoperatively. |
| 2 | Patients having total or subtotal pancreatectomy, including pancreatic head resection, require PERT postoperatively. |
| 3 | After pancreatectomy an individual’s nutritional status (including serum levels of vitamins and minerals) should be monitored so that appropriate treatment can be provided. |
| 4 | Patients who are pancreatic-sufficient in the early period after any pancreatic resection should have long-term assessment for the development of PEI. |
| 5 | PERT is required in patients after pancreaticogastrostomy because of the effect of acid on endogenous enzymes. |
| 6 | PERT following pancreatectomy should be individualized and titrated to indicators of PEI, bearing in mind asynchrony and bacterial overgrowth. |
Table 1 Nutritional supplement after pancreatectomy. ERAS guideline, 2012 [7]
Table 2 PERT recommendation from Australia study group [28]

 E-submission
E-submission KSPEN
KSPEN KSSMN
KSSMN ASSMN
ASSMN JSSMN
JSSMN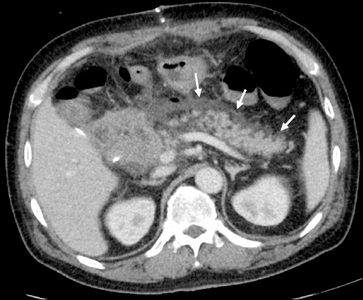
 Cite
Cite

